ПОДПИСАТЬСЯ НА РАССЫЛКУ
Ответы 81-102
81. Иодтиронины - строение, синтез, механизм действия, биологическая роль. Гипо- и гипертиреозы.
Щитовидная железа секретирует иодтиронины - тироксин (Т4) и трииодтиронин (Т3). Это иодированные производные аминокислоты тирозина (см. рисунок 8).
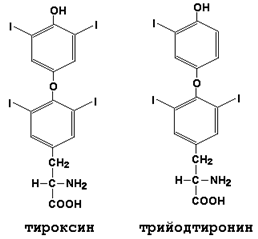
Рисунок 8. Формулы гормонов щитовидной железы (иодтиронинов).
Предшественником Т4 и Т3 служит белок тиреоглобулин, содержащийся во внеклеточном коллоиде щитовидной железы. Это крупный белок, содержащий около 10% углеводов и много тирозиновых остатков (рисунок 9). Щитовидная железа обладает способностью накапливать ионы иода (I-), из которых образуется “активный иод”. Радикалы тирозина в составе тиреоглобулина подвергаются иодированию “активным иодом” - образуются моноиодтирозин (МИТ) и дииодтирозин (ДИТ). Затем происходит конденсация двух иодированных остатков тирозина с образованием Т4 и Т3, включённых в полипептидную цепь. В результате гидролиза иодированного тиреоглобулина под действием лизосомальных протеаз образуются свободные Т4 и Т3 поступают в кровь. Секреция иодтиронинов регулируется тиреотропным гормоном (ТТГ) гипофиза (см. таблицу 2). Катаболизм тиреоидных гормонов осуществляется путём отщепления иода и дезаминирования боковой цепи.
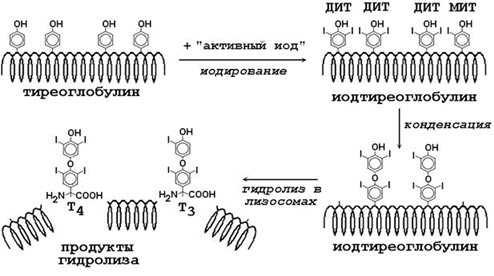
Рисунок 9. Схема синтеза иодтиронинов.
Поскольку Т3 и Т4 практически нерастворимы в воде, в крови они присутствуют в виде комплексов с белками, главным образом с тироксинсвязывающим глобулином (фракция α1-глобулинов).
Иодтиронины - гормоны прямого действия. Внутриклеточные рецепторы для них имеются во всех тканях и органах, кроме головного мозга и гонад. Т4 и Т3 являются индукторами более 100 различных белков-ферментов. Под действием иодтиронинов в тканях-мишенях осуществляется:
1) регуляция роста и дифференцировки клеток;
2) регуляция энергетического обмена (увеличение количества ферментов окислительного фосфорилирования, Na+, К+-АТФазы, повышение потребления кислорода, увеличение теплопродукции).
Под влиянием тиреоидных гормонов ускоряется всавывание глюкозы в кишечнике, усиливается поглощение и окисление глюкозы в мышцах и печени; активируется гликолиз, в органах уменьшается содержание гликогена. Иодтиронины усиливают выведение холестерола, поэтому содержание его в крови снижается. Снижается также содержание триацилглицеролов в крови, что объясняется активацией окисления жирных кислот.
29.3.2. Нарушения гормональной функции щитовидной железы. Гиперфункция щитовидной железы (тиреотоксикоз или базедова болезнь) характеризуется ускоренным распадом углеводов и жиров, повышением потребления О2тканями. Симптомы заболевания: увеличение основного обмена, повышение температуры тела, потеря в весе, учащённый пульс, повышенная нервная возбудимость, пучеглазие (экзофтальм).
Гипофункция щитовидной железы, развивающаяся в детском возрасте, носит название кретинизм (выраженная физическая и умственная отсталость, карликовый рост, непропорциональное сложение, снижение основного обмена и температуры тела). Гипофункция щитовидной железы у взрослых проявляется как микседема. Для этого заболевания характерны ожирение, слизистый отёк, нарушение памяти, психические расстройства. Основной обмен и температура тела снижены. Для лечения гипотиреоза используют заместительную гормонотерапию (иодтиронины).
Известен также эндемический зоб - увеличение размеров щитовидной железы. Заболевание развивается вследствие недостатка йода в воде и пище.
82. Паратгормон и кальцитонин, строение, механизм действия, биологическая роль. Гипер- и гипопаратиреозы.
Контроль уровня ионов кальция и фосфатов в организме осуществляют гормоны щитовидной железы и расположенных в непосредственной близости от неё четырёх паращитовидных желез. Эти железы продуцируют кальцитонин и паратгормон.
29.4.1. Кальцитонин - гормон пептидной природы, синтезируется в парафолликулярных клетках щитовидной железы в виде препрогормона. Активация происходит путём частичного протеолиза. Секреция кальцитонина стимулируется при гиперкальциемии и понижается при гипокальциемии. Мишенью гормона является костная ткань. Механизм действия - дистантный, опосредованный цАМФ. Под влиянием кальцитонина ослабляется деятельность остеокластов (клеток, разрушающих кость) и активируется деятельность остеобластов (клеток, участвующих в формировании костной ткани). В результате этого тормозится резорбция костного материала - гидроксиапатита - и усиливается его отложение в органическом матриксе кости. Наряду с этим кальцитонин предохраняет от распада и органическую основу кости - коллаген - и стимулирует его синтез. Это приводит к снижению уровня Са2+ и фосфатов в крови и уменьшению выведения Са2+ с мочой (рисунок 10).
29.4.2. Паратгормон - гормон пептидной природы, синтезируемый клетками паращитовидных желёз в виде белка-предшественника. Частичный протеолиз прогормона и секреция гормона в кровь происходит при снижении концентрации Са2+ в крови; наоборот, гиперкальциемия снижает секрецию паратгормона. Органы-мишени паратгормона - почки, кости и желудочно-кишечный тракт. Механизм действия - дистантный, цАМФ-зависимый. Паратгормон оказывает активирующее действие на остеокласты костной ткани и угнетает деятельность остеобластов. В почках паратгормон повышает способность образовывать активный метаболит витамина D3 - 1,25-дигидроксихолекальциферол (кальцитриол). Это вещество повышает всасывание в кишечнике ионов Са2+ и Н2РО4- , мобилизует Са2+ и неорганический фосфат из костной ткани и увеличивает реабсорбцию Са2+ в почках. Все эти процессы приводят к повышению уровня Са2+ в крови (рисунок 10). Уровень неорганического фосфата в крови не повышается, так как паратгормон тормозит реабсорбцию фосфатов в канальцах почек и приводит к потере фосфатов с мочой (фосфатурия).
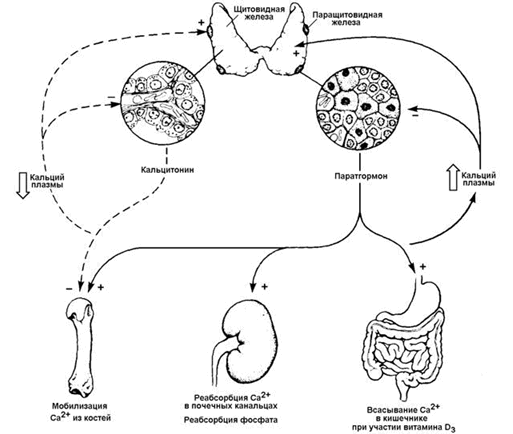
Рисунок 10. Биологические эффекты кальцитонина и паратгормона.
29.4.3. Нарушения гормональной функции паращитовидных желёз.
Гиперпаратиреоз - повышенная продукция паратгормона паращитовидными железами. Сопровождается массивной мобилизацией Са2+ из костной ткани, что приводит к переломам костей, кальцификации сосудов, почек и других внутренних органов.
Гипопаратиреоз - пониженная продукция паратгормона паращитовидными железами. Сопровождается резким снижением содержания Са2+ в крови, что приводит к повышению возбудимости мышц, судорожным сокращениям.
83. Ренин-ангиотензиновая система, роль в регуляции водно-электролитного обмена.
Ренин-ангиотензин-альдостерон. Поддержание стабильной концентрации ионов натрия в крови и объём циркулирующей крови регулируется системой ренин-ангиотензин-альдостерон, которая влияет также на реабсорбцию воды. Уменьшение объёма крови, вызванное потерей натрия, стимулирует группу клеток, расположенных в стенках приносящих артериол - юкстагломерулярный аппарат (ЮГА). В него входят специализированные рецепторные и секреторные клетки. Активация ЮГА приводит к высвобождению из его секреторных клеток протеолитического фермента ренина. Ренин высвобождается из клеток также в ответ на снижение артериального давления крови.
Ренин воздействует на ангиотензиноген (белок a2-глобулиновой фракции), и расщепляет его с образованием декапептида ангиотензина I. Затем другой протеолитический фермент отщепляет от ангиотензина I два концевых аминокислотных остатка с образованием ангиотензина II. Этот октапептид является одним из наиболее активных средств, способствующих сужению кровеносных сосудов, в том числе артериол. В результате увеличивается кровяное давление, снижаются как почечный кровоток, так и клубочковая фильтрация.
Кроме того, ангиотензин II стимулирует секрецию клетками коркового слоя надпочечников гормона альдостерона. Альдостерон - гормон прямого действия - оказывает эффект на дистальный извитой каналец нефрона. Этот гормон индуцирует в клетках-мишенях синтез:
а) белков, участвующих в транспорте Na+ через люминальную поверхность клеточной мембраны;
б) Na+,K+-АТФазы, встраивающейся в контрлюминальную мембрану и участвующей в транспорте Na+ из клеток канальцев в кровь;
в) ферментов митохондрий, например, цитратсинтазы;
г) ферментов, участвующих в образовании фосфолипидов мембран, что облегчает транспорт Na+ в клетки канальца.
Таким образом, альдостерон повышает скорость реабсорбции Na+ из почечных канальцев (за ионами Na+ пассивно следуют ионы Cl—) и в конечном счёте осмотическую реабсорбцию воды, стимулирует активный перенос К+ из плазмы крови в мочу.
84. Половые гормоны - механизм действия, биологическая роль, образование, строение,
Женские половые гормоны (эстрогены). К ним относятся эстрон, эстрадиол и эстриол. Это стероидные гормоны, синтезируемые из холестерола главным образом в яичниках. Секреция эстрогенов регулируется фолликулостимулирующим и лютеинизирующим гормонами гипофиза (см. таблицу 2). Ткани-мишени - тело матки, яичники, маточные трубы, грудные железы. Механизм действия - прямой. Основная биологическая роль эстрогенов заключается в обеспечении репродуктивной функции в организме женщины.
29.5.2. Мужские половые гормоны (андрогены). Главными представителями являются андростерон и тестостерон. Предшественником андрогенов является холестерол, синтезируются они главным образом в семенниках. Регуляция биосинтеза андрогенов осуществляется гонадотропными гормонами (ФСГ и ЛГ). Андрогены - гормоны прямого действия, они способствуют синтезу белка во всех тканях, особенно в мышцах. Биологическая роль андрогенов в мужском организме связана с дифференцировкой и функционированием репродуктивной системы. Распад мужских половых гормонов осуществляется в печени, конечными продуктами распада являются 17-кетостероиды.
85. Нарушения функций эндокринных желез: гипер- и гипопродукция гормонов. Примеры заболеваний, связанных с дисфункцией эндокринных желез.
(Освещено в предыдущих вопросах)
86. Белки плазмы крови — биологическая роль. Гипо- и гиперпротеинемии, диспротеинемия. Альбумин — функции, причины гипоальбуминемии и ее проявления. Возрастные особенности белкового состава плазмы крови. Иммуноглобулины. Белки острой фазы. Диагностическое значение определения фракций белков плазмы крови.
Плазма крови содержит сложную многокомпонентную (более 100) смесь белков, различающихся по происхождению и функциям. Большинство белков плазмы синтезируется в печени. Иммуноглобулины и ряд других защитных белков иммунокомпетентными клетками.
Содержание общего белка в сыворотке крови здорового человека составляет 65 - 85 г/л (в плазме крови этот показатель на 2 – 4 г/л выше за счёт фибриногена).
30.2.1. Белковые фракции. При помощи высаливания белков плазмы можно выделить альбуминовую и глобулиновую фракции. В норме соотношение этих фракций составляет 1,5 – 2,5. Использование метода электрофореза на бумаге позволяет выявить 5 белковых фракций (в порядке убывания скорости миграции): альбумины, α1-, α2-, β- и γ-глобулины. При использовании более тонких методов фракционирования в каждой фракции, кроме альбуминовой, можно выделить целый ряд белков (содержание и состав белковых фракций сыворотки крови см. рисунок 1).
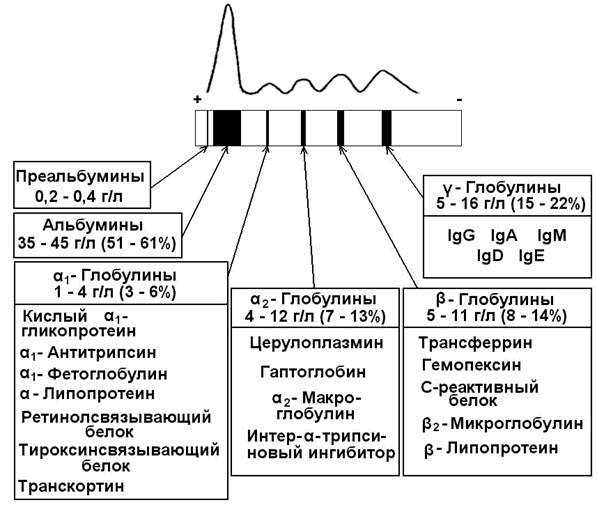
Рисунок 1. Электрофореграмма белков сыворотки крови и состав белковых фракций.
Альбумины – белки с молекулярной массой около 70000 Да. Благодаря гидрофильности и высокому содержанию в плазме играют важную роль в поддержании коллоидно-осмотического (онкотического) давления крови и регуляции обмена жидкостей между кровью и тканями. Выполняют транспортную функцию: осуществляют перенос свободных жирных кислот, желчных пигментов, стероидных гормонов, ионов Са2+, многих лекарств. Альбумины также служат богатым и быстро реализуемым резервом аминокислот.
α1-Глобулины:
- Кислый α1-гликопротеин (орозомукоид) – содержит до 40% углеводов, изоэлектрическая точка его находится в кислой среде (2,7). Функция этого белка до конца не установлена; известно, что на ранних стадиях воспалительного процесса орозомукоид способствует образованию коллагеновых волокон в очаге воспаления (Я.Мусил, 1985).
- α1-Антитрипсин – ингибитор ряда протеаз (трипсина, химотрипсина, калликреина, плазмина). Врождённое снижение содержания α1-антитрипсина в крови может быть фактором предрасположенности к бронхо-лёгочным заболеваниям, так как эластические волокна лёгочной ткани особенно чувствительны к действию протеолитических ферментов.
- Ретинолсвязывающий белок осуществляет транспорт жирорастворимого витамина А.
- Тироксинсвязывающий белок – связывает и транспортирует иодсодержащие гормоны щитовидной железы.
- Транскортин – связывает и транспортирует глюкокортикоидные го рмоны (кортизол, кортикостерон).
α2-Глобулины:
- Гаптоглобины (25% α2-глобулинов) – образуют стабильный комплекс с гемоглобином, появляющимся в плазме в результате внутрисосудистого гемолиза эритроцитов. Комплексы гаптоглобин-гемоглобин поглощаются клетками РЭС, где гем и белковые цепи подвергаются распаду, а железо повторно используется для синтеза гемоглобина. Тем самым предотвращается потеря железа организмом и повреждение почек гемоглобином.
- Церулоплазмин – белок, содержащий ионы меди (одна молекула церулоплазмина содержит 6-8 ионов Cu2+), которые придают ему голубую окраску. Является транспортной формой ионов меди в организме. Обладает оксидазной активностью: окисляет Fe2+ в Fe3+, что обеспечивает связывание железа трансферрином. Способен окислять ароматическиеамины, участвует в обмене адреналина, норадреналина, серотонина.
β-Глобулины:
- Трансферрин – главный белок β-глобулиновой фракции, участвует в связывании и транспорте трёхвалентного железа в различные ткани, особенно в кроветворные. Трансферрин регулирует содержание Fe3+ в крови, предотвращает избыточное накопление и потерю с мочой.
- Гемопексин – связывает гем и предотвращает его потерю почками. Комплекс гем-гемопексин улавливается из крови печенью.
- С-реактивный белок (С-РБ) – белок, способный преципитировать (в присутствии Са2+) С-полисахарид клеточной стенки пневмококка. Биологическая роль его определяется способностью активировать фагоцитоз и ингибировать процесс агрегации тромбоцитов. У здоровых людей концентрация С-РБ в плазме ничтожно мала и стандартными методами не определяется. При остром воспалительном процессе она увеличивается более чем в 20 раз, в этом случае С-РБ обнаруживается в крови. Исследование С-РБ имеет преимущество перед другими маркерами воспалительного процесса: определением СОЭ и подсчётом числа лейкоцитов. Данный показатель более чувствителен, его увеличение происходит раньше и после выздоровления быстрее возвращается к норме.
γ-Глобулины:
- Иммуноглобулины (IgA, IgG, IgM, IgD, IgE) представляют собой антитела, вырабатываемые организмом в ответ на введение чужеродных веществ с антигенной активностью. Подробнее об этих белках см. 1.2.5.
30.2.2. Количественные и качественные изменения белкового состава плазмы крови. При различных патологических состояниях белковый состав плазмы крови может изменяться. Основными видами изменений являются:
- Гиперпротеинемия - увеличение содержания общего белка плазмы. Причины: потеря большого количества воды (рвота, диарея, обширные ожоги), инфекционные заболевания (за счёт увеличения количества γ-глобулинов).
- Гипопротеинемия - уменьшение содержания общего белка в плазме. Наблюдается при заболеваниях печени (вследствие нарушения синтеза белков), при заболеваниях почек (вследствие потери белков с мочой), при голодании (вследствие недостатка аминокислот для синтеза белков).
- Диспротеинемия - изменение процентного соотношения белковых фракций при нормальном содержании общего белка в плазме крови, например, снижение содержания альбуминов и увеличение содержания одной или нескольких глобулиновых фракций при различных воспалительных заболеваниях.
- Парапротеинемия - появление в плазме крови патологических иммуноглобулинов - парапротеинов, отличающихся от нормальных белков по физико-химическим свойствам и биологической активности. К таким белкам относятся, например, криоглобулины, образующие друг с другом преципитаты при температуре ниже 37° С. Парапротеины обнаруживаются в крови при макроглобулинемии Вальденстрема, при миеломной болезни (в последнем случае они могут преодолевать почечный барьер и обнаруживаться в моче как белки Бенс-Джонса). Парапротеинемия, как правило, сопровождается гиперпротеинемией.
елки острой фазы воспаления. Это белки, содержание которых увеличивается в плазме крови при остром воспалительном процессе. К ним относятся, например, следующие белки:
- гаптоглобин;
- церулоплазмин;
- С-реактивный белок;
- α1-антитрипсин;
- фибриноген (компонент свёртывающей системы крови; см. 30.7.2).
Скорость синтеза этих белков увеличивается прежде всего за счёт снижения образования альбуминов, трансферрина и альбуминов (небольшая фракция белков плазмы, обладающая наибольшей подвижностью при диск-электрофорезе, и которой соответствует полоса на электрофореграмме перед альбуминами), концентрация которых при остром воспалении снижается.
Биологическая роль белков острой фазы: а) все эти белки являются ингибиторами ферментов, освобождаемых при разрушении клеток, и предупреждают вторичное повреждение тканей; б) эти белки обладают иммунодепрессорным действием (В.Л.Доценко, 1985).
30.2.5. Защитные белки плазмы крови. К белкам, выполняющим защитную функцию, относятся иммуноглобулины и интерфероны.
Иммуноглобулины (антитела) - группа белков, вырабатываемых в ответ на попадание в организм чужеродных структур (антигенов). Они синтезируются в лимфоузлах и селезёнке лимфоцитами В. Выделяют 5 классов иммуноглобулинов - IgA, IgG, IgM, IgD, IgE.
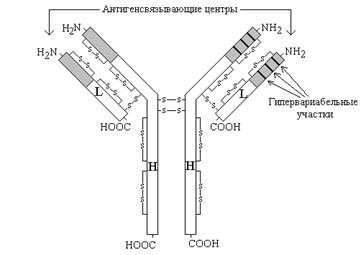
Рисунок 3. Схема строения иммуноглобулинов (серым цветом показана вариабельная область, не закрашена - константная область).
Молекулы иммуноглобулинов имеют единый план строения. Структурную единицу иммуноглобулина (мономер) образуют четыре полипептидные цепи, соединённые между собой дисульфидными связями: две тяжёлые (цепи Н) и две лёгкие (цепи L) (см. рисунок 3). IgG, IgD и IgЕ по своей структуре, как правило, являются мономерами, молекулы IgM построены из пяти мономеров, IgA состоят из двух и более структурных единиц, или являются мономерами.
Белковые цепи, входящие в состав иммуноглобулинов, можно условно разделить на специфические домены, или области, имеющие определённые структурные и функциональные особенности.
N-концевые участки как L-, так и Н-цепей называются вариабельной областью (V), так как их структура характеризуется существенными различиями у разных классов антител. Внутри вариабельного домена имеются 3 гипервариабельных участка, отличающихся наибольшим разнообразием аминокислотной последовательности. Именно вариабельная область антител ответственна за связывание антигенов по принципу комплементарности; первичная структура белковых цепей в этой области определяет специфичность антител.
С-концевые домены Н- и L-цепей обладают относительно постоянной первичной структурой в пределах каждого класса антител и называются константной областью (С). Константная область определяет свойства различных классов иммуноглобулинов, их распределение в организме, может принимать участие в запуске механизмов, вызывающих уничтожение антигенов.
Интерфероны - семейство белков, синтезируемых клетками организма в ответ на вирусную инфекцию и обладающих противовирусным эффектом. Различают несколько типов интерферонов, обладающих специфическим спектром действия: лейкоцитарный (α-интерферон), фибробластный (β-интерферон) и& иммунный (γ-интерферон). Интерфероны синтезируются и секретируются одними клетками и проявляют свой эффект, воздействуя на другие клетки, в этом отношении они подобны гормонам. Механизм действия интерферонов показан на рисунке 4.
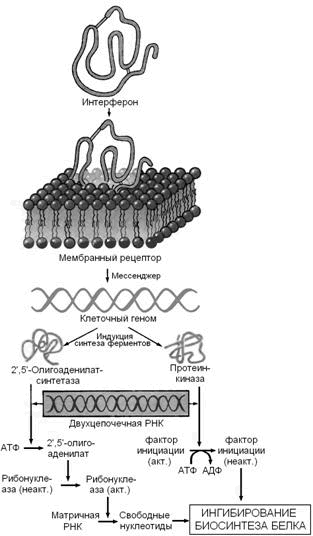
Рисунок 4. Механизм действия интерферонов (Ю.А.Овчинников, 1987).
Связываясь с клеточными рецепторами, интерфероны индуцируют синтез двух ферментов — 2',5'-олигоаденилатсинтетазы и протеинкиназы, вероятно, за счет инициации транскрипции соответствующих генов. Оба образующихся фермента проявляют свою активность в присутствии двухцепочечных РНК, а именно такие РНК являются продуктами репликации многих вирусов или содержатся в их вирионах. Первый фермент синтезирует 2',5'-олигоаденилаты (из АТФ), которые активируют клеточную рибонуклеазу I; второй фермент фосфорилирует фактор инициации трансляции IF2. Конечным результатом этих процессов является ингибирование биосинтеза белка и размножения вируса в инфицированной клетке (Ю.А.Овчинников, 1987).
87. Низкомолекулярные азотсодержащие вещества крови ("остаточный азот'') и диагностическое значение их определения. Гиперазотемия (ретенционная и продукционная).
К этой группе веществ относятся: мочевина, мочевая кислота, аминокислоты, креатин, креатинин, аммиак, индикан, билирубин и другие соединения (см. рисунок 5). Содержание остаточного азота в плазме крови здоровых людей - 15-25 ммоль/л. Повышение содержания остаточного азота в крови называется азотемией. В зависимости от причины, азотемия подразделяется на ретенционную и продукционную.
Ретенционная азотемия возникает при нарушении выведения продуктов азотистого обмена (в первую очередь мочевины) с мочой и характерна для недостаточности функции почек. В этом случае до 90% небелкового азота крови приходится на азот мочевины вместо 50% в норме.
Продукционная азотемия развивается при избыточном поступлении азотистых веществ в кровь вследствие усиленного распада тканевых белков (длительное голодание, сахарный диабет, тяжёлые ранения и ожоги, инфекционные заболевания).
Определение остаточного азота проводят в в безбелковом фильтрате сыворотки крови. В результате минерализации безбелкового фильтрата при нагревании с концентрированной Н2SO4 азот всех небелковых соединений переходит в форму (NH4)2SO4. Ионы NH4+ определяют с помощью реактива Несслера.
- Мочевина - главный конечный продукт обмена белков в организме человека. Образуется в результате обезвреживания аммиака в печени, выводится из организма почками. Поэтому содержание мочевины в крови снижается при заболеваниях печени и возрастает при почечной недостаточности.
- Аминокислоты - поступают в кровь при всасывании из желудочно-кишечного тракта или являются продуктами распада тканевых белков. В крови здоровых людей среди аминокислот преобладают аланин и глутамин, которые наряду с участием в биосинтезе белков являются транспортными формами аммиака.
- Мочевая кислота - конечный продукт катаболизма пуриновых нуклеотидов. Содержание её в крови возрастает при подагре (в результате усиленного образования) и при нарушениях функции почек (из-за недостаточного выведения).
- Креатин - синтезируется в почках и печени, в мышцах превращается в креатинфосфат - источник энергии для процессов мышечного сокращения. При заболеваниях мышечной системы содержание креатина в крови значительно возрастает.
- Креатинин - конечный продукт азотистого обмена, образуется в результате дефосфорилирования креатинфосфата в мышцах, выводится из организма почками. Содержание креатинина в крови снижается при заболеваниях мышечной системы, повышается при почечной недостаточности.
- Индикан - продукт обезвреживания индола, образуется в печени, выводится почками. Содержание его в крови снижается при заболеваниях печени, повышается - при усилении процессов гниения белков в кишечнике, при заболеваниях почек.
- Билирубин (прямой и непрямой) - продукты катаболизма гемоглобина. Содержание билирубина в крови увеличивается при желтухах: гемолитической (за счёт непрямого билирубина), обтурационной (за счёт прямого билирубина), паренхиматозной (за счёт обеих фракций).
88. Буферные системы крови и кислотно-основное состояние (КОС). Роль дыхательной и выделительной систем в поддержании КОС. Нарушения кислотно-основного баланса. Особенности регуляции КОС у детей.
Буферные системы крови. Буферные системы организма состоят из слабых кислот и их солей с сильными основаниями. Каждая буферная система характеризуется двумя показателями:
- рН буфера (зависит от соотношения компонентов буфера);
- буферная ёмкость, то есть количество сильного основания или кислоты, которое нужно прибавить к буферному раствору для изменения рН на единицу (зависит от абсолютных концентраций компонентов буфера).
Различают следующие буферные системы крови:
- бикарбонатная (H2CO3/NaHCO3);
- фосфатная (NaH2PO4/Na2HPO4);
- гемоглобиновая (дезоксигемоглобин в качестве слабой кислоты/ калиевая соль оксигемоглобина);
- белковая (действие её обусловлено амфотерностью белков). Бикарбонатная и тесно связанная с ней гемоглобиновая буферные системы составляют в совокупности более 80% буферной ёмкости крови.
30.6.2. Дыхательная регуляция КОС осуществляется путём изменения интенсивности внешнего дыхания. При накоплении в крови СО2 и Н+ усиливается лёгочная вентиляция, что приводит к нормализации газового состава крови. Снижение концентрации углекислоты и Н+ вызывает уменьшение лёгочной вентиляции и нормализацию данных показателей.
30.6.3. Почечная регуляция КОС осуществляется главным образом за счёт трёх механизмов:
- реабсорбции бикарбонатов (в клетках почечных канальцев из Н2О и СО2 образуется угольная кислота Н2СО3; она диссоциирует, Н+ выделяется в мочу, НСО3— реабсорбируетоя в кровь);
- реабсорбции Na+ из клубочкового фильтрата в обмен на Н+ (при этом Na2HPO4 в фильтрате переходит в NaH2PO4 и увеличивается кислотность мочи);
- секреции NH4+ (при гидролизе глутамина в клетках канальцев образуется NH3; он взаимодействует с H+, образуются ионы NH4+, которые выводятся с мочой.
30.6.4. Лабораторные показатели КОС крови. Для характеристики КОС используют следующие показатели:
- рН крови;
- парциальное давление СО2 (рСО2) крови;
- парциальное давление О2 (рО2) крови;
- содержание бикарбонатов в крови при данных значениях рН и рСО2 (актуальный или истинный бикарбонат, АВ);
- содержание бикарбонатов в крови пациента в стандартных условиях, т.е. при рСО2=40 мм рт.ст. (стандартный бикарбонат, SB);
- сумма оснований всех буферных систем крови (ВВ);
- избыток или дефицит оснований крови по сравнению с нормальным для данного пациента показателем (BE, от англ. base excess).
Первые три показателя определяются непосредственно в крови с помощью специальных электродов, на основании полученных данных рассчитываются остальные показатели с помощью номограмм или формул.
30.6.5. Нарушения КОС крови. Известны четыре главные формы нарушений кислотно-основного состояния:
- метаболический ацидоз - возникает при сахарном диабете и голодании (за счёт накопления кетоновых тел в крови), при гипоксии (за счёт накопления лактата). При этом нарушении снижается рСО2 и [НСО3-] крови, увеличивается экскреция NH4+ с мочой;
- дыхательный ацидоз - возникает при бронхите, пневмонии, бронхиальной астме (в результате задержки углекислоты в крови). При этом нарушении повышается рСО2 и [HCO3-] крови, увеличивается экскреция NH4+ с мочой;
- метаболический алкалоз - развивается при потере кислот, например, при неукротимой рвоте. При этом нарушении повышается рСО2 и [HCO3-] крови, увеличивается экскреция НСО3- с мочой, снижается кислотность мочи.
- дыхательный алкалоз - наблюдается при усиленной вентиляции лёгких, например, у альпинистов на большой высоте. При этом нарушении снижается рСО2 и [НСО3-] крови, уменьшается кислотность мочи.
Для лечения метаболического ацидоза используют введение раствора бикарбоната натрия; для лечения метаболического алкалоза - введение раствора глутаминовой кислоты.
89. Метаболизм эритроцита: роль гликолиза и пентозофосфатного пути. Метгемоглобинемия. Ферментативная антиоксидантная система клетки. Причины и последствия дефицита глюкозо-6-фосфатдегидрогеназы эритроцитов.
Эритроциты - высокоспециализированные клетки, основной функцией которых является транспорт кислорода из лёгких в ткани. Продолжительность жизни эритроцитов составляет в среднем 120 суток; разрушение их происходит в клетках ретикуло-эндотелиальной системы. В отличие от большинства клеток организма, у эритроцита отсутствуют клеточное ядро, рибосомы и митохондрии.
30.8.2. Энергетический обмен. Основным энергетическим субстратом эритроцита является глюкоза, которая поступает из плазмы крови путём облегчённой диффузии. Около 90% используемой эритроцитом глюкозы подвергается гликолизу(анаэробному окислению) с образованием конечного продукта - молочной кислоты (лактата). Запомните функции, которые выполняет гликолиз в зрелых эритроцитах:
1) в реакциях гликолиза образуется АТФ путём субстратного фосфорилирования. Основное направление использования АТФ в эритроцитах - обеспечение работы Na+,K+-АТФазы. Этот фермент осуществляет транспорт ионов Nа+ из эритроцитов в плазму крови, препятствует накоплению Na+ в эритроцитах и способствует сохранению геометрической формы этих клеток крови (двояковогнутый диск).
2) в реакции дегидрирования глицеральдегид-3-фосфата в гликолизе образуется НАДН. Этот кофермент является кофактором фермента метгемоглобинредуктазы, участвующей в восстановлении метгемоглобина в гемоглобин по следующей схеме:
![]()
Эта реакция препятствует накоплению метгемоглобина в эритроцитах.
3) метаболит гликолиза 1,3-дифосфоглицерат способен при участии фермента дифосфоглицератмутазы в присутствии 3-фосфоглицерата превращаться в 2,3-дифосфоглицерат:

2,3-Дифосфоглицерат принимает участие в регуляции сродства гемоглобина к кислороду. Его содержание в эритроцитах повышается при гипоксии. Гидролиз 2,3-дифосфоглицерата катализирует фермент дифосфоглицератфосфатаза.
Приблизительно 10% глюкозы, потребляемой эритроцитом, используется в пентозофосфатном пути окисления. Реакции этого пути служат основным источником НАДФН для эритроцита. Данный кофермент необходим для перевода окисленного глутатиона (см. 30.8.3) в восстановленную форму. Дефицит ключевого фермента пентозофосфатного пути - глюкозо-6-фосфатдегидрогеназы - сопровождается уменьшением в эритроцитах отношения НАДФН/НАДФ+, увеличением содержания окисленной формы глутатиона и снижением резиcтентности клеток (гемолитическая анемия).
30.8.3. Механизмы обезвреживания активных форм кислорода в эритроцитах. Молекулярный кислород в определённых условиях может превращаться в активные формы, к которым относятся супероксидный анион О2-, пероксид водорода Н2О2, гидроксильный радикал ОН. и синглетный кислород 1О2. Эти формы кислорода обладают высокой реакционной способностью, могут оказывать повреждающее действие на белки и липиды биологических мембран, вызывать разрушение клеток. Чем выше содержание О2, тем больше образуется его активных форм. Поэтому эритроциты, постоянно взаимодействующие с кислородом, содержат эффективные антиоксидантные системы, способные обезвреживать активные метаболиты кислорода.
Важным компонентом антиоксидантных систем является трипептид глутатион, образующийся в эритроцитах в результате взаимодействия γ-глутамилцистеина и глицина:
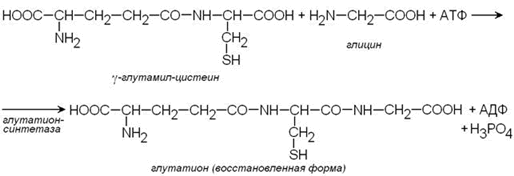
Восстановленная форма глутатиона (сокращённое обозначение Г-SH) участвует в реакциях обезвреживания пероксида водорода и органических пероксидов (R-O-OH). При этом образуются вода и окисленный глутатион (сокращённое обозначение Г-S-S-Г).

Превращение окисленного глутатиона в восстановленный катализирует фермент глутатионредуктаза. Источник водорода - НАДФН (из пентозофосфатного пути, см. 30.8.2):
![]()
В эритроцитах имеются также ферменты супероксиддисмутаза и каталаза, осуществляющие следующие превращения:

Антиоксидантные системы имеют для эритроцитов особое значение, так как в эритроцитах не происходит обновления белков путём синтеза.
90. Характеристика основных факторов гемокоагуляции. Свертывание крови как каскад реакций активации проферментов путем протеолиза. Биологическая роль витамина К. Гемофилии.
Свёртывание крови - совокупность молекулярных процессов, приводящих к прекращению кровотечения из повреждённого сосуда в результате образования кровяного сгустка (тромба). Общая схема процесса свёртывания крови представлена на рисунке 7.
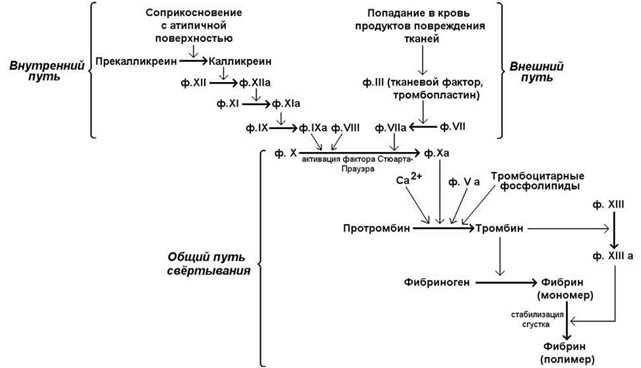
Рисунок 7. Общая схема свёртывания крови.
Большинство факторов свёртывания присутствует в крови в виде неактивных предшественников - проферментов, активация которых осуществляется путём частичного протеолиза. Ряд факторов свёртывания крови являются витамин К-зависимыми: протромбин (фактор II), проконвертин (фактор VII), факторы Кристмаса (IX) и Стюарта-Прауэра (Х). Роль витамина К определяется участием в карбоксилировании остатков глутамата в N-концевом участке этих белков с образованием γ-карбоксиглутамата.
Свёртывание крови представляет собой каскад реакций, в котором активированная форма одного фактора свёртывания катализирует активацию следующего до тех пор, пока конечный фактор, который является структурной основой тромба, не будет активирован.
Особенности каскадного механизма заключаются в следующем:
1) в отсутствие фактора, инициирующего процесс тромбообразования, реакция не может произойти. Поэтому процесс свёртывания крови будет ограничен только тем участком кровяного русла, где появляется такой инициатор;
2) факторы, действующие на начальных этапах свёртывания крови, требуются в очень малых количествах. На каждом звене каскада их эффект многократно усиливается (амплифицируется), что обеспечивает в итоге быструю ответную реакцию на повреждение.
В обычных условиях существуют внутренний и внешний пути свёртывания крови. Внутренний путь инициируется соприкосновением с атипичной поверхностью, что приводит к активации факторов, исходно присутствовавших в крови.Внешний путь свёртывания инициируется соединениями, в обычных условиях в крови не присутствующими, но поступающими туда в результате повреждения тканей. Для нормального протекания процесса свёртывания крови необходимы оба эти механизма; они различаются только на начальных этапах, а затем объединяются в общий путь, приводящий к образованию фибринового сгустка.
Далее рассматриваются только молекулярные механизмы общего пути свёртывания – активация протромбина и превращение фибриногена в фибрин-мономер и фибрин-полимер.
30.7.2. Механизм активации протромбина. Неактивный предшественник тромбина – протромбин – синтезируется в печени. В его синтезе участвует витамин К. Протромбин содержит остатки редкой аминокислоты – γ-карбоксиглутамата сокращённое обозначение – Gla). В процессе активации протромбина участвуют тромбоцитарные фосфолипиды, ионы Са2+ и факторы свёртывания Va и Хa. Механизм активации представляется следующим образом (рисунок 8).

Рисунок 8. Схема активации протромбина на тромбоцитах (Р.Марри и соавт., 1993).
Повреждение кровеносного сосуда приводит к взаимодействию тромбоцитов крови с коллагеновыми волокнами сосудистой стенки. Это вызывает разрушение тромбоцитов и способствует выходу наружу отрицательно заряженных молекул фосфолипидов внутренней стороны плазматической мембраны тромбоцитов. Отрицательно заряженные группировки фосфолипидов связывают ионы Са2+. Ионы Са2+ в свою очередь взаимодействуют с остатками γ-карбоксиглутамата в молекуле протромбина. Эта молекула фиксируется на мембране тромбоцита в нужной ориентации.
Тромбоцитарная мембрана содержит также рецепторы для фактора Va. Этот фактор связывается с мембраной и присоединяет фактор Хa. Фактор Хa является протеазой; он расщепляет молекулу протромбина в определённых местах, в результате образуется активный тромбин.
30.7.3. Превращение фибриногена в фибрин. Фибриноген (фактор I) - растворимый гликопротеин плазмы с молекулярной массой около 340 000. Он синтезируется в печени. Молекула фибриногена состоит из шести полипептидных цепей: две А α-цепи, две В β-цепи, и две γ-цепи (см. рисунок 9). Концы полипептидных цепей фибриногена несут отрицательный заряд. Это обусловлено присутствием большого количества остатков глутамата и аспартата в N-концевых областях цепей Аa и Вb. Кроме того, В-области цепей Вb содержат остатки редкой аминокислоты тирозин-О-сульфата, также заряженные отрицательно:
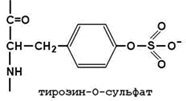
Это способствует растворимости белка в воде и препятствует агрегации его молекул.
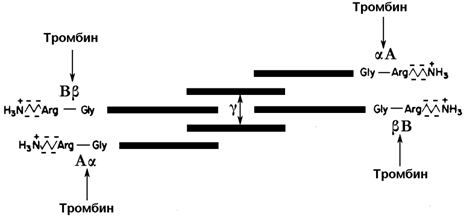
Рисунок 9. Схема строения фибриногена; стрелками показаны связи, гидролизуемые тромбином. Р.Марри и соавт., 1993).
Превращение фибриногена в фибрин катализирует тромбин (фактор IIa). Тромбин гидролизует четыре пептидные связи в фибриногене: две связи в цепях А α и две связи в цепях В β. От молекулы фибриногена отщепляются фибринопептиды А и В и образуется фибрин-мономер (его состав α2 β2 γ2). Мономеры фибрина нерастворимы в воде и легко ассоциируют друг с другом, образуя фибриновый сгусток.
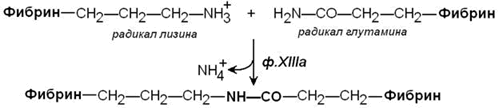
Стабилизация фибринового сгустка происходит под действием фермента трансглутаминазы (фактор XIIIa). Этот фактор также активируется тромбином. Трансглутаминаза образует поперечные сшивки между мономерами фибрина при помощи ковалентных изопептидных связей.
91. Роль печени в углеводном обмене. Источники глюкозы крови и пути метаболизма глюкозы в печени. Уровень глюкозы в крови в раннем детском возрасте.
Печень является органом, занимающим уникальное место в обмене веществ. В каждой печёночной клетке содержится несколько тысяч ферментов, катализирующих реакции многочисленных метаболических путей. Поэтому печень выполняет в организме целый ряд метаболических функций. Важнейшими из них являются:
- биосинтез веществ, которые функционируют или используются в других органах. К этим веществам относятся белки плазмы крови, глюкоза, липиды, кетоновые тела и многие другие соединения;
- биосинтез конечного продукта азотистого обмена в организме - мочевины;
- участие в процессах пищеварения - синтез желчных кислот, образование и экскреция желчи;
- биотрансформация (модификация и конъюгация) эндогенных метаболитов, лекарственных препаратов и ядов;
- выделение некоторых продуктов метаболизма (желчные пигменты, избыток холестерола, продукты обезвреживания).
Основная роль печени в обмене углеводов заключается в поддержании постоянного уровня глюкозы в крови. Это осуществляется путём регуляции соотношения процессов образования и утилизации глюкозы в печени.
В клетках печени содержится фермент глюкокиназа, катализирующий реакцию фосфорилирования глюкозы с образованием глюкозо-6-фосфата. Глюкозо-6-фосфат является ключевым метаболитом углеводного обмена; основные пути его превращения представлены на рисунке 1.
31.2.1. Пути утилизации глюкозы. После приёма пищи большое количество глюкозы поступает в печень по воротной вене. Эта глюкоза используется прежде всего для синтеза гликогена (схема реакций приводится на рисунке 2). Содержание гликогена в печени здоровых людей обычно составляет от 2 до 8% массы этого органа.
Гликолиз и пентозофосфатный путь окисления глюкозы в печени служат в первую очередь поставщиками метаболитов-предшественников для биосинтеза аминокислот, жирных кислот, глицерола и нуклеотидов. В меньшей степени окислительные пути превращения глюкозы в печени являются источниками энергии для обеспечения биосинтетических процессов.
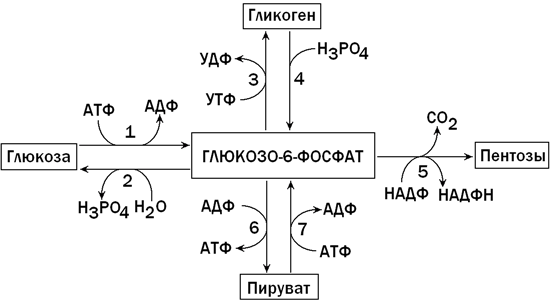
Рисунок 1. Главные пути превращения глюкозо-6-фосфата в печени. Цифрами обозначены: 1 - фосфорилирование глюкозы; 2 - гидролиз глюкозо-6-фосфата; 3 - синтез гликогена; 4 - мобилизация гликогена; 5 - пентозофосфатный путь; 6 - гликолиз; 7 - глюконеогенез.
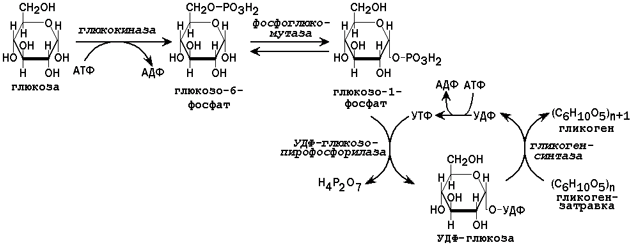
Рисунок 2. Схема реакций синтеза гликогена в печени.
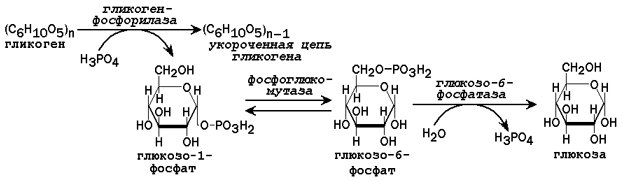
Рисунок 3. Схема реакций мобилизации гликогена в печени.
31.2.2. Пути образования глюкозы. В некоторых условиях (при голодании низкоуглеводной диете, длительной физической нагрузке) потребность организма в углеводах превышает то количество, которое всасывается из желудочно-кишечного тракта. В таком случае образование глюкозы осуществляется с помощью глюкозо-6-фосфатазы, катализирующей гидролиз глюкозо-6-фосфата в клетках печени. Непосредственным источником глюкозо-6-фосфата служит гликоген. Схема мобилизации гликогена представлена на рисунке 3.
Мобилизация гликогена обеспечивает потребности организма человека в глюкозе на протяжении первых 12 - 24 часов голодания. В более поздние сроки основным источником глюкозы становится глюконеогенез - биосинтез из неуглеводных источников.
Основными субстратами для глюконеогенеза служат лактат, глицерол и аминокислоты (за исключением лейцина). Эти соединения сначала превращаются в пируват или оксалоацетат - ключевые метаболиты глюконеогенеза.
Глюконеогенез - процесс, обратный гликолизу. При этом барьеры, создаваемые необратимыми реакциями гликолиза, преодолеваются при помощи специальных ферментов, катализирующих обходные реакции (см. рисунок 4).
Из других путей обмена углеводов в печени следует отметить превращение в глюкозу других пищевых моносахаридов - фруктозы и галактозы.
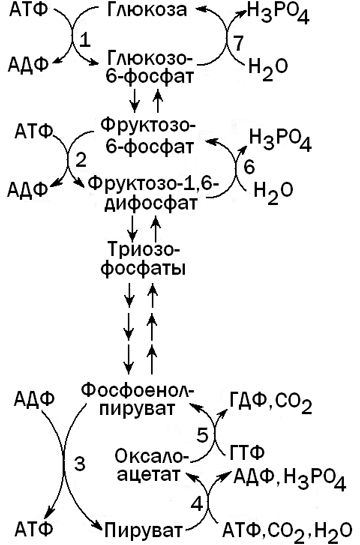
Рисунок 4. Гликолиз и глюконеогенез в печени.
Ферменты, катализирующие необратимые реакции гликолиза: 1 - глюкокиназа; 2 - фосфофруктокиназа; 3 - пируваткиназа.
Ферменты, катализирующие обходные реакции глюконеогенеза: 4 -пируваткарбоксилаза; 5 - фосфоенолпируваткарбоксикиназа; 6 -фруктозо-1,6-дифосфатаза; 7 - глюкозо-6-фосфатаза.
92. Роль печени в обмене липидов.
В гепатоцитах содержатся практически все ферменты, участвующие в метаболизме липидов. Поэтому паренхиматозные клетки печени в значительной степени контролируют соотношение между потреблением и синтезом липидов в организме. Катаболизм липидов в клетках печени протекает главным образом в митохондриях и лизосомах, биосинтез - в цитозоле и эндоплазматическом ретикулуме. Ключевым метаболитом липидного обмена в печени является ацетил-КоА, главные пути образования и использования которого показаны на рисунке 5.
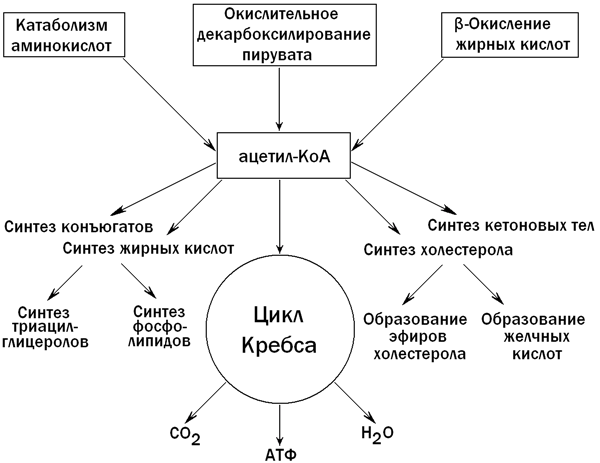
Рисунок 5. Образование и использование ацетил-КоА в печени.
31.3.1. Метаболизм жирных кислот в печени. Пищевые жиры в виде хиломикронов поступают в печень через систему печёночной артерии. Под действием липопротеинлипазы, находящейся в эндотелии капилляров, они расщепляются до жирных кислот и глицерола. Жирные кислоты, проникающие в гепатоциты, могут подвергаться окислению, модификации (укорочению или удлинению углеродной цепи, образованию двойных связей) и использоваться для синтеза эндогенных триацилглицеролов и фосфолипидов.
31.3.2. Синтез кетоновых тел. При β-окислении жирных кислот в митохондриях печени образуется ацетил-КоА, подвергающийся дальнейшему окислению в цикле Кребса. Если в клетках печени имеется дефицит оксалоацетата (например, при голодании, сахарном диабете), то происходит конденсация ацетильных групп с образованием кетоновых тел (ацетоацетат,β-гидроксибутират, ацетон). Эти вещества могут служить энергетическими субстратами в других тканях организма (скелетные мышцы, миокард, почки, при длительном голодании - головной мозг). Печень не утилизирует кетоновые тела. При избытке кетоновых тел в крови развивается метаболический ацидоз. Схема образования кетоновых тел - на рисунке 6.

Рисунок 6. Синтез кетоновых тел в митохондриях печени.
31.3.3. Образование и пути использования фосфатидной кислоты. Общим предшественником триацилглицеролов и фосфолипидов в печени является фосфатидная кислота. Она синтезируется из глицерол-3-фосфата и двух ацил-КоА - активных форм жирных кислот (рисунок 7). Глицерол-3-фосфат может образоваться либо из диоксиацетонфосфата (метаболит гликолиза), либо из свободного глицерола (продукт липолиза).
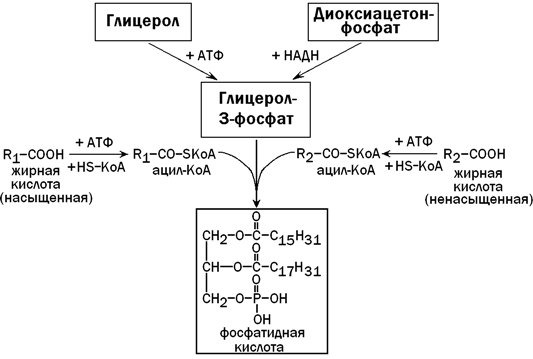
Рисунок 7. Образование фосфатидной кислоты (схема).
Для синтеза фосфолипидов (фосфатидилхолина) из фосфатидной кислоты необходимо поступление с пищей достаточного количества липотропных факторов (веществ, препятствующих развитию жировой дистрофии печени). К этим факторам относятся холин, метионин, витамин В12, фолиевая кислота и некоторые другие вещества. Фосфолипиды включаются в состав липопротеиновых комплексов и принимают участие в транспорте липидов, синтезированных в гепатоцитах, в другие ткани и органы. Недостаток липотропных факторов (при злоупотреблении жирной пищей, хроническом алкоголизме, сахарном диабете) способствует тому, что фосфатидная кислота используется для синтеза триацилглицеролов (нерастворимых в воде). Нарушение образования липопротеинов приводит к тому, что избыток ТАГ накапливается в клетках печени (жировая дистрофия) и функция этого органа нарушается. Пути использования фосфатидной кислоты в гепатоцитах и роль липотропных факторов показаны на рисунке 8.
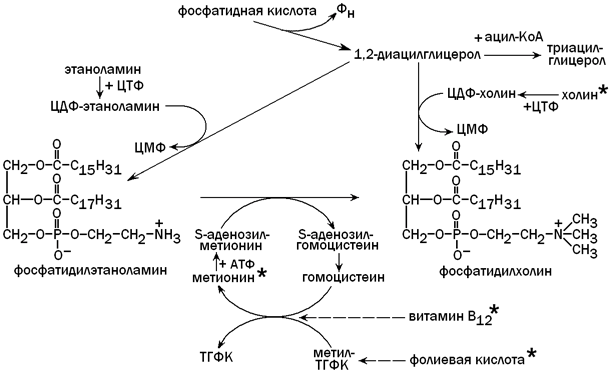
Рисунок 8. Использование фосфатидной кислоты для синтеза триацилглицеролов и фосфолипидов. Липотропные факторы обозначены знаком * .
31.3.4. Образование холестерола. Печень является основным местом синтеза эндогенного холестерола. Это соединение необходимо для построения клеточных мембран, является предшественником желчных кислот, стероидных гормонов, витамина Д3. Первые две реакции синтеза холестерола напоминают синтез кетоновых тел, но протекают в цитоплазме гепатоцита. Ключевой фермент синтеза холестерола - β-гидрокси-β-метилглутарил-КоА-редуктаза (ГМГ-КоА-редуктаза)ингибируется избытком холестерола и желчными кислотами по принципу отрицательной обратной связи (рисунок 9).
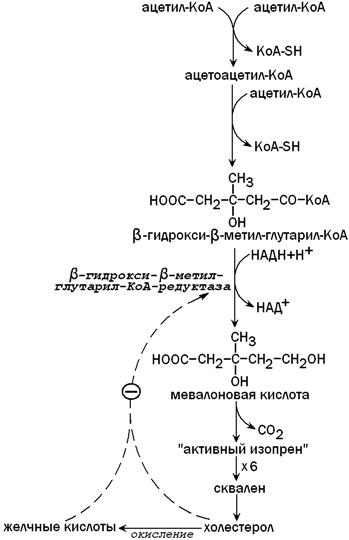
Рисунок 9. Синтез холестерола в печени и его регуляция.
31.3.5. Образование липопротеинов. Липопротеины - белково-липидные комплексы, в состав которых входят фосфолипиды, триацилглицеролы, холестерол и его эфиры, а также белки (апопротеины). Липопротеины транспортируют нерастворимые в воде липиды к тканям. В гепатоцитах образуются два класса липопротеинов - липопротеины высокой плотности (ЛПВП) и липопротеины очень низкой плотности (ЛПОНП).
93. Роль печени в азотистом обмене. Пути использования фонда аминокислот в печени. Особенности в детском возрасте.
Печень является органом, регулирующим поступление азотистых веществ в организм и их выведение. В периферических тканях постоянно протекают реакции биосинтеза с использованием свободных аминокислот, либо выделение их в кровь при распаде тканевых белков. Несмотря на это, уровень белков и свободных аминокислот в плазме крови остаётся постоянным. Это происходит благодаря тому, что в клетках печени имеется уникальный набор ферментов, катализирующих специфические реакции обмена белков.
31.4.1. Пути использования аминокислот в печени. После приёма белковой пищи в клетки печени по воротной вене поступает большое количество аминокислот. Эти соединения могут претерпевать в печени ряд превращений, прежде чем поступить в общий кровоток. К этим реакциям относятся (рисунок 10):
а) использование аминокислот для синтеза белков;
б) трансаминирование - путь синтеза заменимых аминокислот; осуществляет также взаимосвязь обмена аминокислот с глюконеогенезом и общим путём катаболизма;
в) дезаминирование - образование α-кетокислот и аммиака;
г) синтез мочевины - путь обезвреживания аммиака (схему см. в разделе "Обмен белков");
д) синтез небелковых азотсодержащих веществ (холина, креатина, никотинамида, нуклеотидов и т.д.).
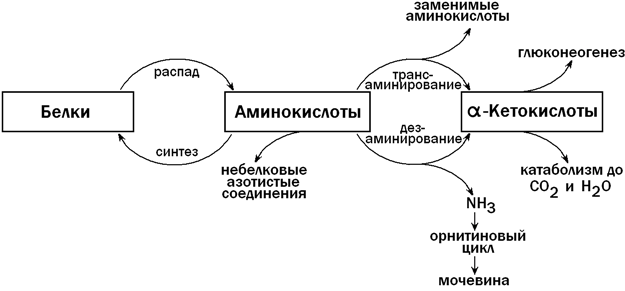
Рисунок 10. Обмен аминокислот в печени (схема).
31.4.2. Биосинтез белков. В клетках печени синтезируются многие белки плазмы крови: альбумины (около 12 г в сутки), большинство α- и β-глобулинов, в том числе транспортные белки (ферритин, церулоплазмин, транскортин, ретинолсвязывающий белок и др.). Многие факторы свёртывания крови (фибриноген, протромбин, проконвертин, проакцелерин и др.) также синтезируются в печени.
94. Компартментализация метаболических процессов в печени. Регуляция направления потока метаболитов через мембраны внутриклеточных (субклеточных) структур. Значение в интеграции обмена веществ.
Клетка - сложнофункциональная система, регулирующая своё жизнеобеспечение. Многообразие функций клетки обеспечивается пространственной и временной (в первую очередь, в зависимости от ритма питания) регуляцией определённых метаболических путей. Пространственная регуляция связана со строгой локализацией определённых ферментов в различных
109
Таблица 2-3. Типы метаболических путей
| Схема | Название | Пример |
| А→В→С→D→Е | Линейный | Гликолиз |
 |
Разветвлённый | Синтез нуклеотидов |
 |
Циклический | Цикл трикарбоновых кислот |
| Синтез мочевины | ||
 |
Спиральный | β-окисление жирных кислот |
органеллах. Так, в ядре находятся ферменты, связанные с синтезом молекул ДНК и РНК, в цитоплазме - ферменты гликолиза, в лизосомах - гидролитические ферменты, в матриксе митохондрий - ферменты ЦТК, во внутренней мембране митохондрий - ферменты цепи переноса электронов и т.д. (рис. 2-29). Такая субклеточная локализация ферментов способствует упорядоченности биохимических процессов и увеличивает скорость обмена веществ.
95. Роль печени в обезвреживании ксенобиотиков. Механизмы обезвреживания веществ в печени. Стадии (фазы) химической модификации. Роль реакций конъюгации в детоксикации продуктов обмена и лекарственных препаратов (примеры). Метаболизм лекарств у детей раннего возраста.
5. Фазы метаболизма ксенобиотиков.
Метаболизм ксенобиотиков включает две стадии (фазы):
1) фаза модификации - процесс изменения структуры ксенобиотика, в результате которого освобождаются или появляются новые полярные группировки (гидроксильные, карбоксильные аминные). Это происходит в результате реакций окисления, восстановления, гидролиза. Образующиеся продукты становятся более гидрофильными, чем исходные вещества.
2) фаза конъюгации - процесс присоединения к молекуле модифицированного ксенобиотика различных биомолекул при помощи ковалентных связей. Это облегчает выведение ксенобиотиков из организма.
96. Монооксигеназная цепь окисления в мембранах эндоплазматической сети печеночных клеток, компоненты, последовательность реакций, роль в метаболизме ксенобиотиков и природных соединений. Цитохром Р450. Индукторы и ингибиторы микросомальных монооксигеназ.
Основной тип реакций этой фазы биотрансформации - микросомальное окисление. Оно происходит при участии ферментов монооксигеназной цепи переноса электронов. Эти ферменты встроены в мембраны эндоплазматического ретикулума гепатоцитов (рисунок 1).
Источником электронов и протонов в этой цепи является НАДФН+Н+, который образуется в реакциях пентозофосфатного пути окисления глюкозы. Промежуточным акцептором Н+ и е— служит флавопротеин, содержащий кофермент ФАД. Конечное звено в цепи микросомального окисления - цитохром Р-450.
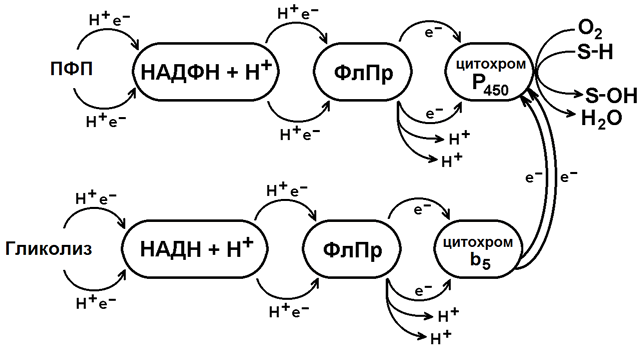
Цитохром P-450 - сложный белок, хромопротеин, в качестве простетической группы содержит гем. Своё название цитохром Р-450 получил в связи с тем, что образует прочный комплекс с оксидом углерода СО, имеющий максимум поглощения при 450 нм. Цитохром Р-450 обладает низкой субстратной специфичностью. Он может взаимодействовать с большим количеством субстратов. Общее свойство всех этих субстратов - неполярность.
Цитохром Р-450 активирует молекулярный кислород и окисляемый субстрат, изменяя их электронную структуру и облегчая процесс гидроксилирования. Механизм гидроксилирования субстратов с участием цитохрома Р-450 показан на рисунке 2.
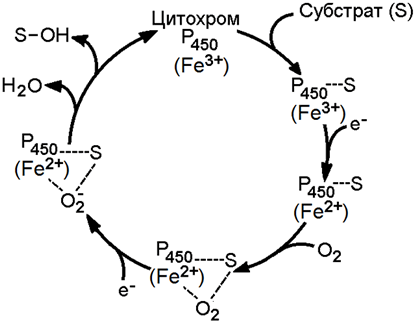
Рисунок 2. Механизм гидроксилирования субстрата при участии цитохрома Р-450.
В этом механизме условно можно выделить 5 основных этапов:
1. Окисляемое вещество (S) образует комплекс с окисленной формой цитохрома Р-450;
2. Происходит восстановление этого комплекса электроном с НАДФН;
3. Восстановленный комплекс соединяется с молекулой O2;
4. О2 в составе комплекса присоединяет ещё один электрон с НАДФН;
5. Комплекс распадается с образованием молекулы Н2О, окисленной формы цитохрома Р-450 и гидроксилированного субстрата (S-ОН).
В отличие от митохондриальной дыхательной цепи, при переносе электронов в монооксигеназной цепи не происходит аккумулирования энергии в виде АТФ. Поэтому микросомальное окисление являетсясвободным окислением.
В большинстве случаев гидроксилирование чужеродных веществ снижает их токсичность. Однако в ряде случаев могут образоваться продукты с цитотоксическими, мутагенными и канцерогенными свойствами.
97. Роль почек в поддержании гомеостаза организма. Механизмы ультрафильтрации, канальцевой реабсорбции и секреции. Гормоны, влияющие на диурез. Физиологическая протеинурия и креатинурия у детей.
Основная функция почек заключается в поддержании постоянства внутренней среды организма человека. Обильное кровоснабжение (за 5 минут через почки проходит вся кровь, циркулирующая в сосудах) обусловливает эффективную регуляцию почками состава крови. Благодаря этому поддерживается и состав внутриклеточной жидкости. При участии почек осуществляются:
- удаление (экскреция) конечных продуктов метаболизма. Почки участвуют в выведении из организма веществ, которые в случае накопления подавляют ферментативную активность. Почки осуществляют также удаление из организма водорастворимых чужеродных веществ или их метаболитов.
- регуляция ионного состава жидкостей организма. Минеральные катионы и анионы, присутствующие в жидкостях организма, участвуют во многих физиологических и биохимических процессах. Если концентрация ионов не будет удерживаться в сравнительно узких пределах, произойдёт нарушение этих процессов.
- регуляция содержания воды в жидкостях организма (осморегуляция). Это имеет огромное значение для поддержания осмотического давления и объёма жидкостей на стабильном уровне.
- регуляция концентрации водородных ионов (рН) в жидкостях организма. рН мочи может колебаться в широких пределах, благодаря чему обеспечивается постоянство рН других биологических жидкостей. Это обусловливает оптимум работы ферментов и возможность протекания катализируемых ими реакций.
- регуляция артериального давления крови. Почки синтезируют и выделяют в кровь фермент ренин, участвующий в образовании ангиотензина - мощного сосудосуживающего фактора.
- регуляция уровня глюкозы в крови. В корковом слое почек происходит глюконеогенез - синтез глюкозы из неуглеводных соединений. Роль этого процесса существенно возрастает при длительном голодании и других экстремальных воздействиях.
- Активация витамина D. В почках образуется биологически активный метаболит витамина D - кальцитриол.
- Регуляция эритропоэза. В почках синтезируется эритропоэтин, повышающий количество эритроцитов в крови.
34.2. Механизмы процессов ультрафильтрации, канальцевой реабсорбции и секреции в почках.
|
|
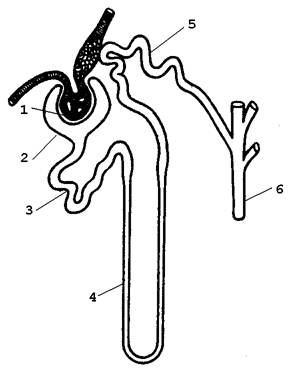
34.2.1. Образование мочи происходит в структурно-функциональных единицах почки – нефронах (рисунок). В почке человека содержится около миллиона нефронов. Морфологически нефрон представлен почечным тельцем, состоящим из сосудистого клубочка (1) и окружающей его капсулы (2), проксимальным канальцем (3), петлёй Генле (4), дистальным канальцем (5), впадающим в собирательную трубочку (6). Моча образуется в результате осуществления трёх процессов, протекающих в каждом нефроне: |
|
Рисунок 34.1. Схема строения нефрона. |
- ультрафильтрации через капилляры клубочка;
- избирательной реабсорбции жидкости в проксимальном канальце, петле Генле, дистальном канальце и собирательной трубочке;
- избирательной секреции в просвет проксимальных и дистальных канальцев, часто сопряжённой с реабсорбцией.
34.2.2. Ультрафильтрация. В результате ультрафильтрации, происходящей в клубочках, из крови удаляются все вещества с молекулярной массой менее 68000 Да и образуется жидкость, называемая клубочковым фильтратом. Вещества фильтруются из крови в клубочковых капиллярах через поры диаметром около 5 нм. Скорость ультрафильтрации довольно стабильна и составляет около 125 мл ультрафильтрата в минуту. По химическому составу клубочковый фильтрат сходен с плазмой крови. Он содержит глюкозу, аминокислоты, водорастворимые витамины, некоторые гормоны, мочевину, мочевую кислоту, креатин, креатинин, электролиты и воду. Белки с молекулярной массой более 68000 Да практически отсутствуют. Ультрафильтрация - процесс пассивный и неизбирательный, поскольку вместе с «отходами» из крови удаляются и вещества, необходимые для жизнедеятельности. Ультрафильтрация зависит только от размеров молекул.
34.2.3. Канальцевая реабсорбция. Реабсорбция, или обратное всасывание веществ, которые могут быть использованы организмом, происходит в канальцах. В проксимальных извитых канальцах всасывается обратно более 80% веществ, в том числе вся глюкоза, практически все аминокислоты, витамины и гормоны, около 85% хлорида натрия и воды. Механизм всасывания можно описать на примере глюкозы.
При участии Na+, K+ -АТФазы, расположенной на базолатеральной мембране клеток канальцев, ионы Na+ переносятся из клеток в межклеточное пространство, а оттуда – в кровь и выводятся из нефрона. В результате создаётся градиент концентрации Na+ между клубочковым фильтратом и содержимым клеток канальцев. Путём облегчённой диффузии Na+ из фильтрата проникает в клетки, одновременно с катионами в клетки поступает глюкоза (против градиента концентрации!). Таким образом, концентрация глюкозы в клетках канальцев почек становится выше, чем во внеклеточной жидкости, и белки-переносчики осуществляют облегчённую диффузию моносахарида в межклеточное пространство, откуда он поступает в кровь.
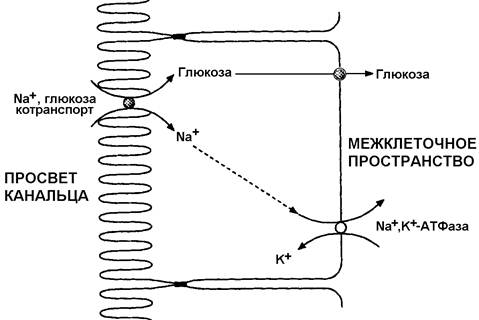
Рисунок 34.2. Механизм реабсорбции глюкозы в проксимальных канальцах почек.
Высокомолекулярные соединения - белки, молекулярная масса которых менее 68000, а также экзогенные вещества (например, рентгеноконтрастные препараты), поступающие в процессе ультрафильтрации в просвет канальца, извлекаются из фильтрата путём пиноцитоза, происходящего у основания микроворсинок. Они оказываются внутри пиноцитозных пузырьков, к которым прикрепляются первичные лизосомы. Гидролитические ферменты лизосом расщепляют белки до аминокислот, которые либо используются самими клетками канальца, либо переходят путём диффузии в околоканальцевые капилляры.
34.2.4. Канальцевая секреция. Нефрон имеет несколько специализированных систем, которые секретируют вещества в просвет канальца посредством переноса их из плазмы крови. Наиболее изучены те системы, которые отвечают за секрецию К+, Н+, NH4+, органических кислот и органических оснований.
Секреция К+ в дистальных канальцах - активный процесс, сопряжённый с реабсорбцией ионов Na+. Этот процесс предотвращает задержку К+ в организме и развитие гиперкалиемии. Механизмы секреции протонов и ионов аммония связаны главным образом с ролью почек в регуляции кислотно-основного состояния. Система, участвующая в секреции органических кислот, имеет отношение к выведению из организма лекарственных препаратов и других чужеродных веществ. Это связано, очевидно, с функцией печени, обеспечивающей модификацию указанных молекул и конъюгацию их с глюкуроновой кислотой или сульфатом. Образующиеся таким путём два типа конъюгатов активно транспортируются системой, которая узнаёт и секретирует органические кислоты. Поскольку конъюгированные молекулы имеют высокую полярность, то после переноса в просвет нефрона они уже не могут диффундировать обратно и выводятся с мочой.
34.3. Гормональные механизмы регуляции почечной функции
34.3.1. В регуляции образования мочи в ответ на осмотический и другие сигналы принимают участие:
а) антидиуретический гормон;
б) система ренин-ангиотензин-альдостерон;
в) система предсердных натрийуретических факторов (атриопептидная система).
34.3.2. Антидиуретический гормон (АДГ, вазопрессин). АДГ синтезируется преимущественно в гипоталамусе в виде белка-предшественника, накапливается в нервных окончаниях задней доли гипофиза, из которых гормон секретируется в кровоток.
Сигналом для секреции АДГ служит повышение осмотического давления крови. Это может иметь место при недостаточном потреблении воды, сильном потоотделении или после приёма большого количества соли. Клетками-мишенями для АДГ являются клетки почечных канальцев, гладкомышечные клетки сосудов, а также клетки печени.
Влияние АДГ на почки заключается в удержании воды в организме путём стимуляции её реабсорбции в дистальных канальцах и собирательных трубочках. Взаимодействие гормона с рецептором активирует аденилатциклазу и стимулирует образование цАМФ. Под действием цАМФ-зависимой протеинкиназы фосфорилируются белки мембраны, обращённой в просвет канальца. Это придаёт мембране способность транспортировать в клетки воду, свободную от ионов. Вода поступает по градиенту концентрации, т.к. канальцевая моча гипотонична по отношению к содержимому клетки.
После приёма большого количества воды осмотическое давление крови снижается и синтез АДГ прекращается. Стенки дистальных канальцев становятся непроницаемыми для воды, реабсорбция воды уменьшается и, как следствие, выводится большой объём гипотонической мочи.
Заболевание, обусловленное дефицитом АДГ, получило название несахарный диабет. Оно может развиваться при нейротропных вирусных инфекциях, черепно-мозговых травмах, опухолях гипоталамуса. Основным симптомом этого заболевания является резкое увеличение диуреза (дол 10 и более литров в сутки) при пониженной (1,001-1,005) относительной плотности мочи.
34.3.3. Ренин-ангиотензин-альдостерон. Поддержание стабильной концентрации ионов натрия в крови и объём циркулирующей крови регулируется системой ренин-ангиотензин-альдостерон, которая влияет также на реабсорбцию воды. Уменьшение объёма крови, вызванное потерей натрия, стимулирует группу клеток, расположенных в стенках приносящих артериол - юкстагломерулярный аппарат (ЮГА). В него входят специализированные рецепторные и секреторные клетки. Активация ЮГА приводит к высвобождению из его секреторных клеток протеолитического фермента ренина. Ренин высвобождается из клеток также в ответ на снижение артериального давления крови.
Ренин воздействует на ангиотензиноген (белок a2-глобулиновой фракции), и расщепляет его с образованием декапептида ангиотензина I. Затем другой протеолитический фермент отщепляет от ангиотензина I два концевых аминокислотных остатка с образованием ангиотензина II. Этот октапептид является одним из наиболее активных средств, способствующих сужению кровеносных сосудов, в том числе артериол. В результате увеличивается кровяное давление, снижаются как почечный кровоток, так и клубочковая фильтрация.
Кроме того, ангиотензин II стимулирует секрецию клетками коркового слоя надпочечников гормона альдостерона. Альдостерон - гормон прямого действия - оказывает эффект на дистальный извитой каналец нефрона. Этот гормон индуцирует в клетках-мишенях синтез:
а) белков, участвующих в транспорте Na+ через люминальную поверхность клеточной мембраны;
б) Na+,K+-АТФазы, встраивающейся в контрлюминальную мембрану и участвующей в транспорте Na+ из клеток канальцев в кровь;
в) ферментов митохондрий, например, цитратсинтазы;
г) ферментов, участвующих в образовании фосфолипидов мембран, что облегчает транспорт Na+ в клетки канальца.
Таким образом, альдостерон повышает скорость реабсорбции Na+ из почечных канальцев (за ионами Na+ пассивно следуют ионы Cl—) и в конечном счёте осмотическую реабсорбцию воды, стимулирует активный перенос К+ из плазмы крови в мочу.
34.3.4. Предсердные натрийуретические факторы. Мышечные клетки предсердий синтезируют и секретируют в кровь пептидные гормоны, регулирующие диурез, экскрецию электролитов с мочой и сосудистый тонус. Эти гормоны получили название атриопептидов (от слова atrium - предсердие).
Атриопептиды млекопитающих независимо от размера молекулы имеют общую характерную структуру. У всех этих пептидов дисульфидная связь между двумя остатками цистеина образует 17-членную кольцевую структуру. Эта кольцевая структура обязательна для проявления биологической активности: восстановление дисульфидной группы приводит к потере активных свойств. От остатков цистеина отходят две пептидные цепи, представляющие N- и С-концевые участки молекулы. Количеством аминокислотных остатков на этих участках и отличаются друг от друга атриопептиды.
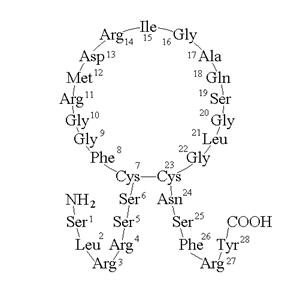
Рисунок 34.3. Схема строения α-натрийуретического пептида.
Специфические белки-рецепторы для атриопептидов расположены на плазматической мембране печени, почек и надпочечников, на эндотелии сосудов. Взаимодействие атриопептидов с рецепторами сопровождается активацией мембраносвязанной гуанилатциклазы, превращающей ГТФ в циклический гуанозинмонофосфат (цГМФ).
В почках под влиянием атриопептидов увеличивается клубочковая фильтрация и диурез, возрастает выделение Na+ с мочой. Одновременно с этим снижается артериальное давление, уменьшается тонус гладкомышечных органов, тормозится секреция альдостерона.
Таким образом, в норме обе регуляторные системы - атриопептидная и ренин-ангиотензиновая - взаимно уравновешивают друг друга. С нарушением этого равновесия связаны тяжелейшие патологические состояния - артериальная гипертензия вследствие стеноза почечных артерий, сердечная недостаточность.
В последние годы всё чаще появляются сообщения о применении атриопептидных гормонов при сердечной недостаточности, уже на ранних стадиях которой происходит уменьшение продукции этого гормона.
98. Важнейшие биополимеры соединительной ткани и межклеточного матрикса (коллаген, эластин, протеогликаны), состав, пространственная структура, биосинтез, функции.
Основные компоненты межклеточного матрикса - структурные белки коллаген и эластин, гликозаминогликаны, протеогликаны, а также неколлагеновые структурные белки (фибронектин, ламинин, тенасцин, остеонектин и др.). Коллагены - семейство родственных фибриллярных белков, секретируемых клетками соединительной ткани. Коллагены - самые распространённые белки не только межклеточного матрикса, но и организма в целом, они составляют около 1/4 всех белков организма человека. Молекулы коллагена состоят из трёх полипептидных цепей, называемых α-цепями. Идентифицировано более 20 α-цепей, большинство которых имеет в своём составе 1000 аминокислотных остатков, но цепи несколько отличаются аминокислотной последовательностью. В состав коллагенов могут входить три одинаковые или разные цепи. Первичная структура α-цепей коллагена необычна, так как каждая третья аминокислота в полипептидной цепи представлена глицином, около 1/4 аминокислотных остатков составляют пролин или 4-гидроксипролин, около 11% - аланин. В составе первичной структуры α-цепи коллагена содержится также необычная аминокислота - гидроксилизин. Спирализованные полипептидные цепи, перевиваясь друг около друга, образуют трёхце-почечную правозакрученную суперспиральную молекулу - тропоколлаген. Синтез и созревание: гидроксилирование пролина и лизина с образованием гидроксипролина (Hyp) и гидроксилизина (Hyl); гликозилирование гидроксилизина; частичный протеолиз - отщепление "сигнального" пептида, а также N- и С-конце-вых пропептидов; образование тройной спирали. Коллагены являются основными структурными компонентами органов и тканей, которые испытывают механическую нагрузку (кости, сухожилия, хрящи, межпозвоночные диски, кровеносные сосуды), а также участвуют в образовании стромы паренхиматозных органов.
Эластин обладает резиноподобными свойствами. Нити эластина, содержащиеся в тканях лёгких, в стенках сосудов, в эластичных связках, могут быть растянуты в несколько раз по сравнению с их обычной длиной, но после снятия нагрузки они возвращаются к свёрнутой конформации. Эластин содержит в составе около 800 аминокислотных остатков, среди которых преобладают аминокислоты с неполярными радикалами, такие как глицин, валин, аланин. Эластин содержит довольно много пролина и лизина, но лишь немного гидроксипролина; полностью отсутствует гидроксилизин. Протеогликаны - высокомолекулярные соединения, состоящие из белка (5-10%) и гликозаминогликанов (90-95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани. Основной протеогликан хрящевого матрикса называется агрекан. Это очень большая молекула, в которой к одной полипептидной цепи присоединены до 100 цепей хондроитинсульфатов и около 30 цепей кератансульфатов (ёршик). В хрящевой ткани молекулы агрекана собираются в агрегаты с гаалуроновой кислотой и небольшим связывающим белком.
Малые протеогликаны - протеогликаны с низкой молекулярной массой. Они содержатся в хрящах, сухожилиях, связках, менисках, коже и других видах соединительной ткани. Эти протеогликаны имеют небольшой коровый белок, к которому присоединены одна или две цепи гликозаминогликанов. Наиболее изучены декорин, бигликан, фибромодулин, люмикан, перлекан. Они могут связываться с другими компонентами соединительной ткани и оказывать влияние на их строение и функции. Например, декорин и фибромодулин присоединяются к фибриллам коллагена II типа и ограничивают их диаметр. Протеогликаны базальных мембран отличаются значительной гетерогенностью. Это преимущественно гепарансульфатсодержащие протеогликаны (ГСПГ).
99. Особенности обмена в скелетных мышцах и миокарде: характеристика основных белков, молекулярные механизмы мышечного сокращения, энергетическое обеспечение мышечного сокращения.
Мышечная ткань составляет 40–42% от массы тела. Основная динамическая функция мышц – обеспечить подвижность путем сокращения и последующего расслабления. При сокращении мышц осуществляется работа, связанная с превращением химической энергии в механическую.
Различают три типа мышечной ткани: скелетную, сердечную и гладкую мышечную ткань.
Существует также деление на гладкие и поперечно-полосатые (исчерченные) мышцы. К поперечно-полосатым мышцам, помимо скелетных, относятся мышцы языка и верхней трети пищевода, внешние мышцы глазного яблока и некоторые другие. Морфологически миокард относится к поперечно-полосатой мускулатуре, но по ряду других признаков он занимает промежуточное положение между гладкими и поперечно-полосатыми мышцами.
МОРФОЛОГИЧЕСКАЯ ОРГАНИЗАЦИЯ ПОПЕРЕЧНО-ПОЛОСАТОЙ МЫШЦЫ
Поперечно-полосатая мышца состоит из многочисленных удлиненных волокон , или мышечных клеток. Двигательные нервы входят в различных точках в мышечное волокно и передают ему электрический импульс, вызывающий сокращение. Мышечное волокно обычно рассматривают как многоядерную клетку гигантских размеров, покрытую эластичной оболочкой – сарколеммой (рис. 20.1). Диаметр функционально зрелого поперечно-полосатого мышечного волокна обычно составляет от 10 до 100 мкм, а длина волокна часто соответствует длине мышцы.
В каждом мышечном волокне в полужидкой саркоплазме по длине волокна расположено, нередко в форме пучков, множество нитевидных образований – миофибрилл (толщина их обычно менее 1 мкм), обладающих, как и все волокно в целом, поперечной исчерченностью. Поперечная исчерченность волокна, зависящая от оптической неоднородности белковых веществ, локализованных во всех миофибриллах на одном уровне, легко выявляется при исследовании волокон скелетных мышц в поляризационном или фазово-контрастном микроскопе.
В мышечной ткани взрослых животных и человека содержится от 72 до 80% воды. Около 20–28% от массы мышцы приходится на долю сухого остатка, главным образом белков. Помимо белков, в состав сухого остатка входят гликоген и другие углеводы, различные липиды, экстрактивные азотсодержащие вещества, соли органических и неорганических кислот и другие химические соединения.
Повторяющимся элементом поперечно-полосатой миофибриллы является саркомер – участок миофибриллы, границами которого служат узкие Z-линии. Каждая миофибрилла состоит из нескольких сот саркомеров. Средняя длина саркомера 2,5–3,0 мкм. В середине саркомера находится зона протяженностью 1,5–1,6 мкм, темная в фазово-контрастном микроскопе. В поляризованном свете она дает сильное двойное лучепреломление. Эту зону принято называть диском А (анизотропный диск). В центре диска А расположена линия М, которую можно наблюдать только в электронном микроскопе. Среднюю часть диска А занимает зона Н более слабого двойного лучепреломления. Наконец, существуют изотропные диски, или диски I, с очень слабым двойным лучепреломлением. В фазово-контраст-ном микроскопе они кажутся более светлыми, чем диски А. Длина дисков I около 1 мкм. Каждый из них разделен на две равные половины Z-мембраной, или Z-линией.
Белки, входящие в состав саркоплазмы, относятся к протеинам, растворимым в солевых средах с низкой ионной силой. Принятое ранее подразделение саркоплазматических белков на миоген, глобулин X, миоальбумин и белки-пигменты в значительной мере утратило смысл, поскольку существование глобулина X и миогена как индивидуальных белков в настоящее время отрицается. Установлено, что глобулин X представляет собой смесь различных белковых веществ со свойствами глобулинов. Термин «миоген» также является собирательным понятием. В частности, в состав белков группы миогена входит ряд протеинов, наделенных ферментативной активностью: например, ферменты гликолиза. К числу саркоплазмати-ческих белков относятся также дыхательный пигмент миоглобин и разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обмена. Недавно была открыта группа саркоплазматических белков – пар-вальбумины, которые способны связывать ионы Са2+. Их физиологическая роль остается еще неясной.
К группе миофибриллярных белков относятся миозин, актин и актомио-зин – белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц.
Рассмотрим, к чему сводятся представления о механизме попеременного сокращения и расслабления мышц. В настоящее время принято считать, что биохимический цикл мышечного сокращения состоит из 5 стадий (рис. 20.8):
1) миозиновая «головка» может гидролизовать АТФ до АДФ и Н3РО4 (Pi), но не обеспечивает освобождения продуктов гидролиза. Поэтому данный процесс носит скорее стехиометрический, чем каталитический, характер (см. рис.);
2) содержащая АДФ и Н3РО4 миозиновая «головка» может свободно вращаться под большим углом и (при достижении нужного положения) связываться с F-актином, образуя с осью фибриллы угол около 90° (см. рис.);
3) это взаимодействие обеспечивает высвобождение АДФ и Н3РО4 из актин-миозинового комплекса. Актомиозиновая связь имеет наименьшую энергию при величине угла 45°, поэтому изменяется угол миозина с осью фибриллы с 90° на 45° (примерно) и происходит продвижение актина (на 10–15 нм) в направлении центра саркомера (см. рис.);
4) новая молекула АТФ связывается с комплексом миозин–F-актин
5) комплекс миозин–АТФ обладает низким сродством к актину, и поэтому происходит отделение миозиновой (АТФ) «головки» от F-актина. Последняя стадия и есть собственно расслабление, которое отчетливо зависит от связывания АТФ с актин-миозиновым комплексом (см. рис. 20.8, д). Затем цикл возобновляется.
100. Особенности обмена в нервной ткани. Биологически активные молекулы нервной ткани.
Особенности обмена в нервной ткани: много липидов, мало углеводов, нет их резерва, высокий обмен дикарбоновых кислот, глюкоза – основной источник энергии, мало гликогена, поэтому мозг зависит от поступления глюкозы с кровью, интенсивный дыхательный обмен, кислород используется постоянно и уровень не меняется, обменные процессы носят обособленный характер благодаря гематоэнцефалическому барьеру, высокая чувствительность к гипоксии и гипогликемии. нейроспецифических белков (НСБ) – биологически активных молекул, специфичных для нервных тканей и выполняющих функции, характерные для нервной системы. Основной белок миелина. Нейронспецифическая енолаза. Белок S-100 и т.д.
101. Взаимосвязь обмена аминокислот, жиров и углеводов. Схема превращений глюкозы и аминокислот в жиры. Схема синтеза глюкозы из аминокислот. Схема образования углеродного скелета аминокислот из углеводов и глицерина.
В печени происходит важнейшее превращение жирных кислот, из которых синтезируются жиры, свойственные для данного вида животного. Под действием фермента липазы жиры расщепляются на жирные кислоты и глицерин. Дальнейшая судьба глицерина похожа на судьбу глюкозы. Его превращение начинается с участием АТФ и заканчивается распадом до молочной кислоты с последующим окислением до углекислого газа и воды. Иногда при необходимости печень может синтезировать гликоген из молочной кислоты.В печени также осуществляется синтез жиров и фосфатидов, которые поступают в кровь, транспортируются по всему организму. Значительную роль она играет в синтезе холестерина и его эфиров. При окислении холестерина в печени образуются желчные кислоты, которые выделяются с желчью и участвуют в процессах пищеварения.
102. Диагностическое значение определения метаболитов в крови и моче.
Глюкоза в норме у здорового человека в моче содержится в крайне малых дозах, примерно 0,03-0,05 г/л. Патологическая гликозурия: почечного диабета, сахарного диабета, острого панкреатита, гипертиреоидизма, стероидного диабета, демпинг-синдорома, инфаркта-миокарда, ожогов, тубулоинтерстициального поражения почек, синдорома Кушинга. В моче здорового человека белок присутствовать не должен. Патологическая протеинурия: при заболевании мочевыводящих путей (воспалительная экссудация), при патологии почек (повреждении клубочков), диабета, различного рода инфекционых заболеваний, интоксикаций и др. В норме содержание мочевины колеблется от 333 до 587 ммоль/сут ( от 20 до 35 г/сут). При превышении мочевины диагностируют лихорадку, гиперфунцию щитовидной железы, злокачественную анемию, после некоторых лекарственных средств. Снижение мочевины наблюдается при токсемии, желтухе, циррозе печени, заболевании почек, во время беременности, при почечной недостаточности, во время диеты с низким содержанием белка. Анализ мочи на мочевую кислоту назначают при подозрении на дефицит фолиевой кислоты, диагностики нарушений пуринового обмена, болезни крови, диагностики эндокриных заболеваний и др. При сниженных значениях мочевой кислты в анализе мочи определяют нарастающую атрофию мыщц, ксантинурию, свинцовую интоксикацию, прием йодида калия, хинина, атропина, при дефиците фолиевой кислоты. Повышенные значения мочевой кислоты наблюдается при эпиляпсиях, вирусном гепатите, цистинозе, синдроме Леша-Нигана, крупозной пневмонии, серповидноклеточной анемии, болезни Вильсона-Коновалова, истинной олицитемии. Креатинин в анализе мочи у взрослых колеблется от 5,3 у женщин и от 7,1 у мужчин до 15,9 и 17,7 ммоль/сут соответственно. Этот показатель используется в оценке функции почек, его так же назначают при беременности, диабете, заболевании эндокриных желез, при уменьшении массы тела и острых и хронических заболеваний почек. Повышенные значения от нормы возникают при физических нагрузках, сахарном диабете, белковой диете, анемии, повышенном метаболизме, инфекциях, беременности, ожогах, гипотиреозе, отравлениях угарным газом и др. Сниженные значения креатинина при вегетарианской диете, лейкозе, параличе, мышечной дистрофии, различного рода воспалительных заболеваниях с вовлечением мышц и др. Назначают анали мочи на фосфор при заболевании костной системы, почек, паращитовидных желез, иммобилизации и при лечении витамином D. При превышении уровня от нормы диагностируют лейкоз, предрасположенность к образованию мочевых камней, рахит, повреждение почечных канальцев, непочечных ацидоз, гиперпаратироидизм, семейная гипофосфатемия. При понижении уровня диагностируют: различные инфекционные заболевания ( нр. туберкулез), паратироидэктомию, метастазы в кости, акромегалию, гипопаратироидизм, острую желтую атрофию и др. Анализ назначают при патологии сердечно-сосудистой системы, неврологической патологии и почечной недостаточности. При повышении содержания магния от нормы определяют: алкоголизм, синдром Барттера, болезнь Аддисона, ранние стадии хронических заболеваний почек и др. Уменьшение: недостаточное содержание магния в пище, панкреатит, острая или хроническая диарея, дегидратация, синдром мальабсорбции и др. Анализ на кальций назначают для оценки паращитовидных желез, диагностики рахита, остеопороза, болезни костей, при заболевании щитовидной железы и гипофиза. В норме активность составляет 10-1240 ед\л. Анализ назначают при вирусных инфекциях, поражениях поджелудочной и околоушных желез, декомпенсированном диабете.
Стандартный биохимический анализ крови.
Глюкоза может быть понижена при некоторых эндокринных заболеваниях, нарушении функции печени. Повышение содержания глюкозы наблюдается при сахарном диабете. Билирубин, может определить, как работает печень. Повышение уровня общего билирубина – симптом желтухи, гепатита, закупорки желчных протоков. Если же повышается содержание связанного билирубина, то, скорее всего, больна печень. Уровень общего белка падает при заболеваниях печени, почек, длительных воспалительных процессах, голодании. Повышение содержания общего белка может наблюдаться при некоторых заболеваниях крови, болезнях и состояниях, сопровождающихся обезвоживанием организма. Падение уровня альбумина может говорить о болезнях печени, почек или кишечника. Обычно этот показатель снижен при сахарном диабете, тяжелой аллергии, ожогах, воспалительных процессах. Повышенный показатель альбумина – сигнал о нарушениях иммунной системы или обмена веществ. Повышение уровня γ-глобулинов говорит о наличии в организме инфекции и воспаления. Снижение может свидетельствовать об иммунодефиците. Повышение содержания α1-глобулинов наблюдается при острых воспалительных процессах. Уровень α2-глобулинов может повышаться при воспалительных и опухолевых процессах, заболеваниях почек, а снижаться при панкреатите и сахарном диабете. Изменение количества β-глобулинов обычно наблюдается при нарушениях жирового обмена. C-реактивный белок при воспалительных процессах, инфекциях, опухолях его содержание увеличивается. Определение этого показателя имеет большое значение при ревматизме и ревматоидном артрите. Повышение уровня холестерина сигнализирует о развитии атеросклероза, ишемической болезни сердца, сосудистых заболеваний и инсульта. Уровень холестерина повышается также при сахарном диабете, хронических заболеваниях почек, снижении функции щитовидной железы. Холестерина становится меньше нормы при повышении функции щитовидной железы, хронической сердечной недостаточности, острых инфекционных заболеваниях, туберкулезе, остром панкреатите и заболеваниях печени, некоторых видах анемии, истощении. Если содержание β-липопротеидов меньше нормы, это говорит о нарушениях функции печени. Повышенный уровень этого показателя указывает на атеросклероз, нарушение обмена жиров, а также сахарный диабет. Триглицериды повышаются при заболеваний почек, снижении функции щитовидной железы. Резкое повышение этого показателя свидетельствует о воспалении поджелудочной железы. Повышение содержания мочевины указывает на заболевание почек. Повышение уровня креатинина свидетельствует о нарушении работы почек, диабете, заболеваниях скелетной мускулатуры. Уровень мочевой кислоты в крови может возрастать при подагре, лейкозах, острых инфекциях, заболеваниях печени, почечно-каменной болезни, сахарном диабете, хронической экземе, псориазе.Изменение уровня амилазы говорит о патологии поджелудочной железы. Увеличение щелочной фосфатазы свидетельствует о заболеваниях печени и желчных протоков. На нарушение функции печени указывает повышение таких показателей, как АлАТ, АсАТ, γ-ГТ. Изменение концентрации фосфора и кальция в крови свидетельствует о нарушении минерального обмена, что бывает при заболеваниях почек, рахите, некоторых гормональных нарушениях.
ОБНОВЛЕНИЯ
ПОДПИСАТЬСЯ НА РАССЫЛКУ
ПРЕДМЕТЫ
- Анатомия
- Акушерство и гинекология
- БЖД, медицина катастроф
- Биохимия
- Биология
- Гистология
- Гигиена
- Генетика
- Диетология
- Дерматовенерология
- Инфекционные болезни
- Культурология
- Лабораторная диагностика
- Летняя практика
- Лучевая диагностика
- Медицинская информатика
- Микробиология
- Неврология
- Общественное здоровье
- Общий уход
О НАС
«Dendrit» - информационный портал для медицинских работников, студентов медицинских ВУЗов, исследователей и пациентов.
Ваш источник новостей и знаний о здоровье.