ПОДПИСАТЬСЯ НА РАССЫЛКУ
Ответы 41-60
41. Сопряжение окисления с фосфорилированием в дыхательной цепи. Н+-АТФсинтетаза мембран митохондрий. Коэффициент Р/О. Разобщение дыхания и фосфорилирования. Гипоэнергетические состояния.
Степень сопряжённости окисления и фосфорилирования в митохондриях характеризует коэффициент фосфорилирования (Р/О). Он равен отношению количества молекул неорганического фосфата (Н3РО4), перешедшего в АТФ, к количеству атомов потреблённого кислорода (О2).
Например, если донором водорода для дыхательной цепи является молекула НАДН, то электроны от донора (НАДН) к акцептору (кислород) проходят 3 участка сопряжения окисления и фосфорилирования (I, III и IV ферментные комплексы дыхательной цепи). Таким образом, максимально может образоваться 3 молекулы АТФ (3 АДФ + 3 Н3РО4 → 3 АТФ). Затрачивается 1 атом кислорода (2 Н + О → Н2О). Значение коэффициента Р/О = 3/1 = 3.
Если донором водорода будет молекула ФАДН2, то электроны в дыхательной цепи проходят 2 участка сопряжения окисления и фосфорилирования (III и IV ферментные комплексы дыхательной цепи). Таким образом, максимально может образоваться 2 молекулы АТФ (2 АДФ + 2 Н3РО4 → 2 АТФ). Затрачивается, как и в предыдущем случае, 1 атом кислорода (2 Н + О → Н2О). Значение коэффициента Р/О = 2/1 = 2.
14.2.2. Более сложный пример расчёта коэффициента фосфорилирования – при окислении пирувата до конечных продуктов - показан на рисунке 14.5. В этом метаболическом пути происходит дегидрирование 4 субстратов (пирувата, изоцитрата, α-кетоглутарата и малата) с образованием НАДН и одного субстрата (сукцината) с образованием ФАДН2. Восстановленные коферменты окисляются в дыхательной цепи, и в сопряжённых реакциях фосфорилирования образуется (4×3 АТФ + 1×2 АТФ)=14 молекул АТФ. Ещё 1 молекула АТФ (ГТФ) образуется в реакции субстратного фосфорилирования на уровне сукцинил-КоА. Таким образом, при полном окислении 1 молекулы пирувата образуется 15 молекул АТФ (из них 14 - путём окислительного фосфорилирования).
Чтобы рассчитать количество потреблённого кислорода, нужно знать число реакций дегидрирования на данном участке метаболического пути. Для окисления каждой восстановленной формы кофермента необходим 1 атом кислорода (см. выше). Следовательно, в нашем примере потребляется 5 атомов кислорода. Значение коэффициента Р/О будет равно 14/5 = 2,8.

Рисунок 14.5. Расчёт энергетического баланса реакций окислительного декарбоксилирования пирувата и цикла Кребса.
Перенос электронов в дыхательной цепи не во всех случаях протекает сопряжённо с фосфорилированием АДФ. Состояние, при котором окисление субстратов в дыхательной цепи происходит, но АТФ при этом не образуется, называется свободным (нефосфорилирующим) окислением. Энергия, выделяемая при окислении, рассеивается в виде теплоты.
В физиологических условиях свободное окисление может служить одним из механизмов терморегуляции. В организме человека и некоторых животных имеется особая ткань – бурый жир, содержащий митохондрии, приспособленные для выработки теплоты. Много бурого жира у новорождённых, в последующие периоды жизни его количество уменьшается. В митохондриях бурого жира содержание дыхательных ферментов значительно выше, чем ферментов, осуществляющих фосфорилирование АДФ, поэтому в них преобладают процессы свободного окисления.
Разобщение процессов окисления и фосфорилирования в митохондриях может иметь место при некоторых патологических состояниях. Основными симптомами таких состояний могут быть быстрая утомляемость, повышенная температура тела, снижение массы тела, несмотря на повышенный аппетит, учащение дыхания и сердцебиения.
14.3.2. Разобщение процессов окисления и фосфорилирования может быть вызвано действием ряда веществ, как природных, так и синтетических. Механизм действия этих веществ заключается в том, что они являются переносчиками протонов через мембрану. Вещества, разобщающие окисление и фосфорилирование, можно разделить на протонофоры и ионофоры.
Протонофоры представляют собой слабые гидрофобные органические кислоты, которые в форме аниона (R-COO-) связывают протоны в межмембранном пространстве, диффундируют через мембрану и диссоциируют в матриксе с образованием протонов. К этой группе относятся, например, свободные жирные кислоты, гормоны щитовидной железы, салицилаты, дикумарол, 2,4-динитрофенол (см. рисунок 14.6).
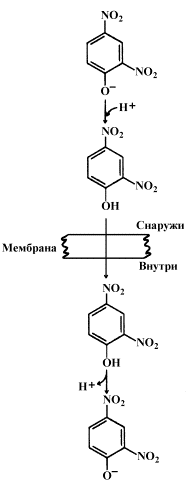
Рисунок 14.6. Механизм действия 2,4-динитрофенола.
Ионофоры (валиномицин, нигерицин, грамицидин) способны встраиваться в мембрану, образуя канал, по которому могут перемещаться протоны и другие одновалентные катионы - Na+ или K+(рисунок 14.7). В результате снимается протонный потенциал и нарушается синтез АТФ.

Рисунок 14.7. Валиномицин облегчает проникновение в клетку ионов Н+.
42. Образование и пути использования глюкозо-6-фосфата в организме. Особенности обмена глюкозо-6-фосфата в различных тканях, обусловленные функциональными различиями этих тканей.
Источниками глюкозо-6-фосфата служат 2 процесса: мобилизация гликогена и глюконеогенез.
- Мобилизация гликогена. В состоянии гипогликемии в крови повышается уровень гормона глюкагона, вырабатываемого а-клетками поджелудочной железы. Подобно адреналину он запускает каскад реакций, приводящих к фосфорилированию внутриклеточных ферментов печени. В том числе, ключевого фермента распада гликогена - гликогенфосфорилазы, что приводит к повышению его активности. Мобилизация гликогена обеспечивает потребности организма человека в глюкозе на протяжении первых 12-24 часов голодания.
- В более поздние сроки голодания основным источником глюкозы становится глюконеогенез - биосинтез глюкозы из неуглеводных источников.
Основными субстратами для глюконеогенеза при голодании служат глицерол и аминокислоты (за исключением лейцина).
Повышение уровня этих субстратов в крови обеспечивается тем же глюкагоном, за счет распада триацилглицеролов в клеткаж жировой ткани и гормонами коркового вещества надпочечников – глюкокортикоидами, которые стимулируют процессы катаболизма белков во внепеченочных тканях. Кроме того, эти гормоны ,индуцируют синтез и повышают активность регуляторных ферментов глюконеогенеза – пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы и фруктозо-1,6-дифосфатазы.
Начальной реакцией превращения глюкозы в клетке является её фосфорилирование в результате взаимодействия с АТФ (рисунок 15.1, реакция 1). Эта реакция в условиях клетки протекает только в одном направлении. Биологическая роль реакции фосфорилирования глюкозы заключается в том, что глюкозо-6-фосфат, в отличие от свободной глюкозы, не может проникать через плазматическую мембрану обратно в кровь и оказывается «запертой» в клетке. Таким образом, глюкозо-6-фосфат является ключевым метаболитом углеводного обмена, на уровне которого осуществляется интеграция различных путей превращения глюкозы в клетке.
В большинстве тканей реакцию фосфорилирования глюкозы катализирует фермент гексокиназа, которая обладает высоким сродством к глюкозе, способна также фосфорилировать фруктозу и маннозу и аллостерически ингибируется избытком глюкозо-6-фосфата. В клетках печени, кроме того, есть фермент глюкокиназа, которая имеет низкое сродство к глюкозе, не ингибируется глюкозо-6-фосфатом и не участвует в фосфорилировании других моносахаридов. Глюкокиназа эффективно функционирует только при высокой концентрации глюкозы в крови. Это способствует усвоению большого количества углеводов, поступающих в печень из кишечника в активную фазу пищеварения.
В следующей реакции глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат.
43. Гликолиз - локализация в клетке и тканях, последовательность реакций, биологическая роль, энергетический баланс. Утилизация молочной кислоты в организме человека. Интенсивность гликолиза в тканях в период внутриутробного развития плода и после рождения.
Гликолиз – это ферментативный распад глюкозы в аэробных условиях до двух молекул пировиноградной кислоты (аэробный гликолиз), а в анаэробных условиях – до двух молекул молочной кислоты (анаэробный гликолиз). В анаэробных условиях гликолиз протекает в тканях без потребления кислорода и является единственным процессом, поставляющим АТФ, так как окислительное фосфорилирование в этих условиях не функционирует. Анаэробный гликолиз происходит во всех тканях, функционирующих в условиях гипоксии, прежде всего в скелетных мышцах. Гликолиз в эритроцитах даже в присутствии кислорода завершается образованием лактата, поскольку в этих клетках отсутствуют митохондрии.
Гликолиз протекает в цитозоле клеток организма. Этот процесс катализируется одиннадцатью ферментами, которые выделены в высокоочищенном состоянии и хорошо изучены. Условно можно разделить гликолиз на две стадии.
15.2.2. Первая стадия гликолиза является подготовительной и включает реакции превращения молекулы глюкозы в две молекулы фосфотриоз. Эта стадия сопровождается затратой молекул АТФ.
Начальной реакцией превращения глюкозы в клетке является её фосфорилирование в результате взаимодействия с АТФ (рисунок 15.1, реакция 1). Эта реакция в условиях клетки протекает только в одном направлении. Биологическая роль реакции фосфорилирования глюкозы заключается в том, что глюкозо-6-фосфат, в отличие от свободной глюкозы, не может проникать через плазматическую мембрану обратно в кровь и оказывается «запертой» в клетке. Таким образом, глюкозо-6-фосфат является ключевым метаболитом углеводного обмена, на уровне которого осуществляется интеграция различных путей превращения глюкозы в клетке.
В большинстве тканей реакцию фосфорилирования глюкозы катализирует фермент гексокиназа, которая обладает высоким сродством к глюкозе, способна также фосфорилировать фруктозу и маннозу и аллостерически ингибируется избытком глюкозо-6-фосфата. В клетках печени, кроме того, есть фермент глюкокиназа, которая имеет низкое сродство к глюкозе, не ингибируется глюкозо-6-фосфатом и не участвует в фосфорилировании других моносахаридов. Глюкокиназа эффективно функционирует только при высокой концентрации глюкозы в крови. Это способствует усвоению большого количества углеводов, поступающих в печень из кишечника в активную фазу пищеварения.
В следующей реакции глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат (рисунок 15.1, реакция 2).
Продукт реакции изомеризации подвергается повторному фосфорилированию за счёт АТФ (рисунок 15.1, реакция 3). Эта реакция – наиболее медленно протекающая реакция гликолиза и, подобно фосфорилированию глюкозы, необратима. Фермент – фосфофруктокиназа – является аллостерическим, активируется АДФ, АМФ, и фруктозо-2,6-бисфосфатом, а ингибируется цитратом и высокой концентрацией АТФ.
На следующем этапе фруктозо-1,6-дифосфат подвергается расщеплению на две фосфотриозы (рисунок 15.1, реакция 4). Таким образом, химическое соединение, содержащее 6 углеродных атомов, превращается в два, содержащих по 3 атома углерода. Поэтому гликолиз называют дихотомическим путём превращения глюкозы (от слова «дихотомия» – рассечение на две части).
Далее происходит изомеризация триозофосфатов (рисунок 15.1, реакция 5). В этой реакции диоксиацетонфосфат переходит в глицеральдегид-3-фосфат. Таким образом, в первой стадии гликолиза молекула глюкозы превращается в две молекулы глицеральдегид-3-фосфата. Поэтому в реакциях второй стадии глюкозы будет участвовать по две молекулы каждого субстрата, что необходимо учитывать при расчёте энергетического баланса данного метаболического пути.

Рисунок 15.1. Реакции первой стадии гликолиза.
15.2.3. Вторая стадия гликолиза включает реакции превращения двух молекул глицеральдегид-3-фосфата в две молекулы лактата. На этой стадии гликолиза происходит синтез молекул АТФ.
Глицеральдегид-3-фосфат подвергается дегидрированию при участии НАД-зависимой дегидрогеназы. В этой реакции происходит потребление неорганического фосфата, который включается в состав продукта реакции, содержащего макроэргическую фосфатную связь (рисунок 15.2, реакция 6), а промежуточным донором водорода служит SH-группа в активном центре фермента, которая потом регенерирует.
1,3-Дифосфоглицерат вступает в реакцию первого субстратного фосфорилирования, т.е. не сопряжённого с переносом электронов в дыхательной цепи. В этой реакции осуществляется синтез молекулы АТФ в результате переноса фосфатной группы вместе с макроэргической связью на молекулу АДФ (рисунок 15.2, реакция 7).
В следующей реакции происходит внутримолекулярное перемещение фосфатной группы 3-фосфоглицерата ко 2-му углеродному атому (рисунок 15.2, реакция 8). Тем самым облегчается последующее отщепление молекулы воды, которое приводит к появлению в продукте реакции макроэргической фосфатной связи (рисунок 15.2, реакция 9).
Фосфоенолпируват (ФЕП) вступает в реакцию второго субстратного фосфорилирования, в ходе которого образуется молекула АТФ. В отличие от первого субстратного фосфорилирования, данная реакция является необратимой в условиях клетки (рисунок 15.2, реакция 10). Фермент пируваткиназа существует в двух изоферментных формах. Изофермент, присутствующий в печёночных клетках, аллостерически ингибируется АТФ и активируется фруктозо-1,6-дифосфатом. Изофермент, присутствующий в головном мозге, мышцах и других тканях, не является аллостерическим и не принимает участия в регуляции гликолиза.
В заключительной реакции гликолиза происходит использование НАДН, образовавшегося при дегидрировании глицеральдегид-3-фосфата (см. реакцию 6). При участии НАД-зависимой лактатдегидрогеназы пируват восстанавливается в молочную кислоту (рисунок 15.2, реакция 11). Фермент существует в пяти изоферментных формах, отличающихся сродством к субстрату и распределением в тканях.
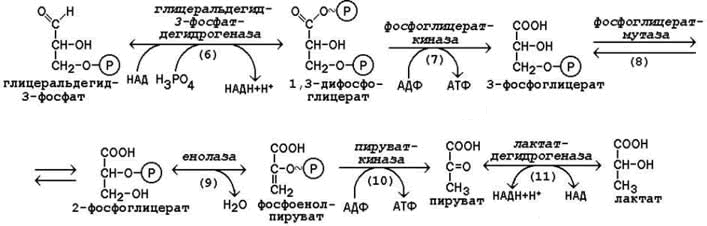
Рисунок 15.2. Реакции второй стадии гликолиза.
Таким образом, в процессе образования лактата из глюкозы в клетке не накапливается НАДН. Это значит, что данный процесс является анаэробным и может протекать без участия кислорода (который является конечным акцептором электронов, передаваемых НАДН в дыхательную цепь). В тканях, функционирующих в условиях гипоксии,
При подсчёте энергетического баланса гликолиза следует учитывать, что каждая из реакций второй стадии этого метаболического пути повторяется дважды. Таким образом, в первой стадии было затрачено 2 молекулы АТФ, а во второй стадии путём субстратного фосфорилирования образовалось 2х2 = 4 молекулы АТФ; следовательно при окислении одной молекулы глюкозы в клетке накапливается 2 молекулы АТФ.
44. Дихотомический аэробный распад глюкозы: схема последовательности реакций, значение. Энергетический баланс аэробного окисления глюкозы.
Аэробным называется окисление биологических субстратов с выделением энергии, протекающее при использовании кислорода в качестве конечного акцептора водорода в дыхательной цепи. В качестве доноров водорода выступают восстановленные формы коферментов (НАДН, ФАДН2 и НАДФН), образующиеся в промежуточных реакциях окисления субстратов.
Аэробное дихотомическое окисление глюкозы является основным путём катаболизма глюкозы в организме человека и может происходить во всех органах и тканях. В результате этих реакций глюкоза расщепляется до СО2 и Н2О, а выделяющаяся энергия аккумулируется в АТФ. В этом процессе можно условно выделить три стадии:
- превращение глюкозы в 2 молекулы пирувата в цитоплазме клеток (специфический путь распада глюкозы);
- окислительное декарбоксилирование пирувата с образованием ацетил-КоА в митохондриях;
- окисление ацетил-КоА в цикле Кребса в митохондриях.
15.3.2. На каждом этапе процесса происходит образование восстановленных форм коферментов, которые окисляются ферментными комплексами дыхательной цепи с образованием АТФ путёмокислительного фосфорилирования. Коферменты, образующиеся на второй и третьей стадиях аэробного окисления глюкозы, подвергаются непосредственному окислению в митохондриях. В то же время НАДН, образующийся в цитоплазме в реакциях первой стадии аэробного окисления, не способен проникать через митохондриальную мембрану. Перенос водорода с цитоплазматического НАДН в митохондрии происходит при помощи специальных челночных циклов, основным из которых является малат-аспартатный челночный механизм. Цитоплазматический НАДН восстанавливает оксалоацетат в малат, который проникает в митохондрию, где окисляется, восстанавливая митохондриальный НАД; в цитоплазму оксалоацетат возвращается в виде аспартата (рисунок 15.3).
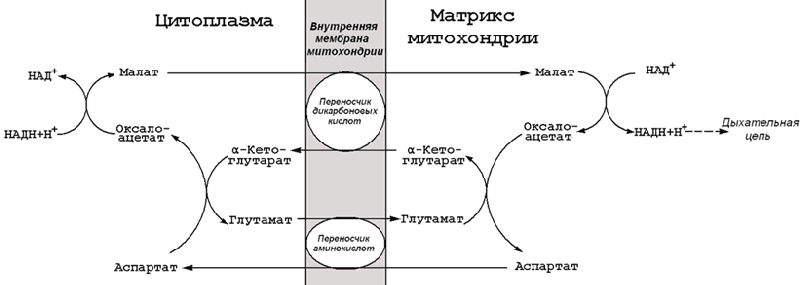
Рисунок 15.3. Малат-аспартатный челночный механизм.
Продукция АТФ в реакциях аэробного дихотомического окисления происходит также в трёх реакциях субстратного фосфорилирования – две из них в гликолизе, третья в цикле Кребса на уровне сукцинил-КоА. Полный энергетический баланс аэробного окисления глюкозы представлен на рисунке 15.4.

Рисунок 15.3. Энергетический баланс аэробного окисления глюкозы.
45. Пентозофосфатный путь превращений глюкозы. Реакции окислительного этапа. Роль пентозофосфатного пути в различных тканях.
Пентозофосфатный путь представляет собой прямое окисление глюкозы и протекает в цитоплазме клеток. Наибольшая активность ферментов пентозофосфатного пути обнаружена в клетках печени, жировой ткани, коры надпочечников, молочной железы в период лактации, зрелых эритроцитах. Низкий уровень этого процесса выявлен в скелетных и сердечной мышцах, мозге, щитовидной железе, легких.
Пентозофосфатный путь называют также апотомическим путём, так как в его реакциях происходит укорочение углеродной цепи гексозы на один атом, который включается в молекулу СО2.
16.1.2. Пентозофосфатный путь выполняет в организме две важнейшие метаболические функции:
16.1.3. В пентозофосфатном пути можно выделить две фазы - окислительную и неокислительную.
Исходным субстратом окислительной фазы является глюкозо-6-фосфат, который непосредственно подвергается дегидрированию с участием НАДФ-зависимой дегидрогеназы (рисунок 16.1, реакция 1). Продукт реакции гидролизуется (реакция 2), а образующийся 6-фосфоглюконат дегидрируется и декарбоксилируется (реакция 3). Таким образом, происходит укорочение углеродной цепи моносахарида на один углеродный атом («апотомия»), и образуется рибулозо-5-фосфат.

Рисунок 16.1. Реакции окислительной фазы пентозофосфатного пути.
16.1.4. Неокислительная фаза пентозофосфатного пути начинается с реакций изомеризации. В ходе этих реакций одна часть рибулозо-5-фосфата изомеризуется в рибозо-5-фосфат, другая - в ксилулозо-5-фосфат (рисунок 16.2, реакции 4 и 5).
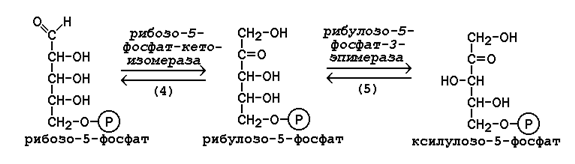
Рисунок 16.2. Реакции изомеризации рибулозо-5-фосфата.
Следуюшая реакция протекает при участии фермента транскетолазы, коферментом которой является тиаминдифосфат (производное витамина B1). В этой реакции происходит перенос двухуглеродного фрагмента с ксилулозо-5-фосфата на рибозо-5-фосфат:
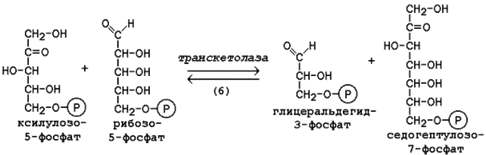
Образовавшиеся продукты взаимодействуют между собой в реакции, которая катализируется трансальдолазой и заключается а переносе остатка дигидроксиацетона на глицеральдегид-3-фосфат.
![]() Продукт этой реакции эритрозо-4-фосфат участвует во второй транскетолазной реакции вместе со следующей молекулой ксилулозо-5-фосфата:
Продукт этой реакции эритрозо-4-фосфат участвует во второй транскетолазной реакции вместе со следующей молекулой ксилулозо-5-фосфата:
![]() Таким образом, три молекулы пентозофосфатов в результате реакций неокислительной стадии превращаются в две молекулы фруктозо-6-фосфата и одну молекулу глицеральдегид-3-фосфата. Фруктозо-6-фосфат может изомеризоваться в глюкозо-6-фосфат, а глицеральдегид-3-фосфат может подвергаться окислению в гликолизе или изомеризоваться в дигидроксиацетонфосфат. Последний вместе с другой молекулой глицеральдегид-3-фосфата может образовывать фруктозо-1,6-дифосфат, который также способен переходить в глюкозо-6-фосфат.
Таким образом, три молекулы пентозофосфатов в результате реакций неокислительной стадии превращаются в две молекулы фруктозо-6-фосфата и одну молекулу глицеральдегид-3-фосфата. Фруктозо-6-фосфат может изомеризоваться в глюкозо-6-фосфат, а глицеральдегид-3-фосфат может подвергаться окислению в гликолизе или изомеризоваться в дигидроксиацетонфосфат. Последний вместе с другой молекулой глицеральдегид-3-фосфата может образовывать фруктозо-1,6-дифосфат, который также способен переходить в глюкозо-6-фосфат.
16.1.5. Посредством пентозофосфатного пути может происходить полное окисление глюкозо-6-фосфата до шести молекул СО2. Все эти молекулы образуются из С-1-атомов шести молекул глюкозо-6-фосфата, а из образовавшихся при этом шести молекул рибулозо-5-фосфата снова регенерируются пять молекул глюкозо-6-фосфата:

Если упростить представленную схему, то получится:
![]()
Таким образом, полное окисление 1 молекулы глюкозы в пентозофосфатном пути сопровождается восстановлением 12 молекул НАДФ.
46. Обмен гликогена. Регуляция синтеза и распада гликогена. Мобилизация гликогена печени: последовательность реакций, каскадный механизм активации фосфорилазы. Нарушения обмена гликогена. Гликогенозы.
Гликоген – биополимер, состоящий из остатков глюкозы, он является компонентом всех тканей животных и человека (см. рисунок 15.1). Этот полисахарид служит основным источником энергии и резервом углеводов в организме.
Содержание гликогена в различных органах зависит от физиологического состояния организма. Наиболее высокое содержание гликогена обнаруживается в печени (от 2 до 6% от массы органа). Хотя концентрация гликогена в мышцах значительно ниже (от 0,5 до 1,5%), однако в норме его количество в мышцах составляет 2/3 от общего его содержания в организме.
Гликоген отличается значительным разнообразием по структуре и по относительной молекулярной массе. Молекулы его ветвисты. Глюкозные остатки образуют цепи, в которых они связаны между собой α-1,4-гликозидными связями. Разветвления образуются при помощи α-1,6-гликозидных связей.
Большая часть глюкозы, поступающей в организм с пищей, превращается в клетках печени в гликоген. Это связано с тем, что накопление легко растворимой глюкозы в клетках привело бы к резкому увеличению осмотического давления и разрушению клеточной мембраны.
16.3.2. Молекула глюкозы фосфорилируется при участии фермента глюкокиназы (в гепатоцитах) или гексокиназы (в других клетках) с образованием глюкозо-6-фосфата. Этот метаболит под влиянием фосфоглюкомутазы превращается в глюкозо-1-фосфат (рисунок 16.7, реакция 1).
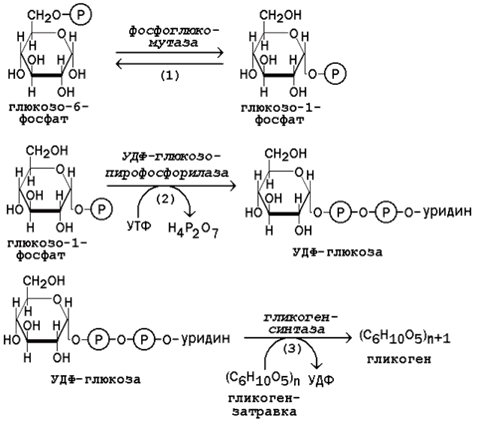
Рисунок 16.7. Реакции биосинтеза гликогена.
Глюкозо-1-фосфат взаимодействует с уридинтрифосфатом (УТФ) в присутствии фермента УДФ-глюкозо-пирофосфорилазы с образованием УДФ-глюкозы – ключевого метаболита углеводного обмена (рисунок 16.7, реакция 2).
Перенос глюкозного остатка с УДФ-глюкозы на затравочную полисахаридную цепь осуществляет гликогенсинтаза – регуляторный фермент данного метаболического пути (рисунок 16.7, реакция 3). Гликогенсинтаза существует в двух формах: гликогенсинтаза b (неактивная) и гликогенсинтаза а (активная). Превращение формы а в форму b катализируется цАМФ-зависимой протеинкиназой, обратный процесс – протеинфосфатазой.
Образование α-1,6-гликозидных связей в молекуле гликогена катализирует ветвящий фермент или трансглюкозидаза (рисунок 16.8) .

Рисунок 16.8. Образование α-1,6-гликозидных связей в молекуле гликогена.
Мобилизация, или распад гликогена – процесс превращения гликогена в глюкозу, происходящий в печени. Таким образом, распад гликогена в печени наряду с глюконеогенезом принимает участие в поддержании уровня глюкозы в крови.
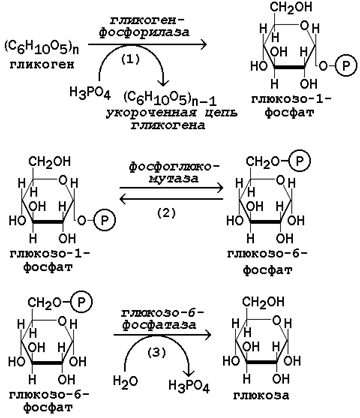
Рисунок 16.9. Реакции мобилизации гликогена.
Первую реакцию внутриклеточного расщепления гликогена катализирует фермент фосфорилаза гликогена (рисунок 16.9, реакция 1). Простетической группой его является пиридоксальфосфат (производное витамина В6).
Фосфорилаза гликогена – регуляторный фермент, он существует в двух формах: фосфорилаза а (активная) и фосфорилаза b (неактивная). Переход фосфорилазы b в фосфорилазу акатализирует киназа фосфорилазы, которая фосфорилирует неактивный фермент. Превращение фосфорилазы а в фосфорилазу b катализирует протеинфосфатаза, которая осуществляет дефосфорилирование активного фермента. Следует отметить, что ускорение процессов мобилизации гликогена происходит одновременно с торможением его биосинтеза, и наоборот. Активацию фосфорилазы гликогена вызывают гормоны адреналин и глюкагон.
Фосфорилаза расщепляет в молекуле гликогена лишь α-1,4-гликозидные связи. Расщепление α-1,6-гликозидных связей осуществляется амило-1,6-гликозидазой гидролитически с образованием свободной глюкозы.
Глюкозо-1-фосфат, образующийся в фосфорилазной реакции, при участии уже известного Вам фермента фосфоглюкомутазы переходит в глюкозо-6-фосфат (рисунок 16.9, реакция 2).
16.4.2. Дальнейшая судьба глюкозо-6-фосфата, образовавшегося при распаде гликогена, в разных тканях различна.
Как уже упоминалось, в печени и почках имеется фермент глюкозо-6-фосфатаза, отщепляющая фосфат от глюкозо-6-фосфата (рисунок 16.9, реакция 3). Образовавшаяся глюкоза диффундирует в кровь, откуда поглощается клетками организма и служит для них источником энергии.
В мышечной ткани фермент глюкозо-6-фосфатаза отсутствует. Поэтому глюкозо-6-фосфат, образовавшийся при распаде гликогена, подвергается дальнейшему превращению по гликолитическому пути с образованием лактата (этот процесс называется гликогенолизом). Образующийся в реакциях субстратного фосфорилирования АТФ используется в процессах мышечного сокращения. Таким образом, гликоген мышц является резервом энергии только для мышечной ткани.
47. Биосинтез глюкозы (глюконеогенез): возможные предшественники, последовательность реакций, значение. Регуляция глюконеогенеза из аминокислот. Интенсивность глюконеогенеза в организме плода и новорожденного ребенка.
Глюконеогенез - биосинтез глюкозы из различных соединений неуглеводной природы. Биологическая роль глюконеогенеза заключается в поддержании постоянного уровня глюкозы в крови, что необходимо для нормального энергообеспечения тканей, для которых характерна непрерывная потребность в углеводах. Особенно это касается центральной нервной системы.
Роль глюконеогенеза возрастает при недостаточном поступлении углеводов с пищей. Так, в организме голодающего человека может синтезироваться до 200 г глюкозы в сутки. Глюконеогенез быстрее, чем другие метаболические процессы, реагирует на изменения диеты: введение с пищей большого количества белков и жиров активизирует процессы глюконеогенеза; избыток углеводов, наоборот, тормозит новообразование глюкозы.
Интенсивные физические нагрузки сопровождаются быстрым истощением запасов глюкозы в организме. В этом случае глюконеогенез является основным путём пополнения углеводных ресурсов, предупреждая развитие гипогликемии. Глюконеогенез в организме тесно связан также с процессами обезвреживания аммиака и поддержанием кислотно-основного баланса.
16.2.2. Основным местом биосинтеза глюкозы de novo является печень. Глюконеогенез протекает также в корковом слое почек. Принято считать, что вклад почек в глюконеогенез в физиологических условиях составляет около 10% глюкозы, синтезируемой в организме; при патологических состояниях эта доля может значительно возрастать. Незначительная активность ферментов глюконеогенеза обнаружена в слизистой тонкого кишечника.
16.2.3. Последовательность реакций глюконеогенеза представляет собой обращение соответствующих реакций гликолиза. Лишь три реакции гликолиза необратимы вследствие происходящих в ходе их значительных энергетических сдвигов:
- а) фосфорилирование глюкозы;
- б) фосфорилирование фруктозо-6-фосфата;
- в) превращение фосфоенолпирувата в пируват.
Обход этих энергетических барьеров обеспечивают ключевые ферменты глюконеогенеза.
Обратный переход пирувата в фосфоенолпируват требует участия двух ферментов. Первый из них – пируваткарбоксилаза - катализирует реакцию образования оксалоацетата (рисунок 16.4, реакция 1). Коферментом пируваткарбоксилазы является биотин (витамин Н). Реакция протекает в митохондриях. Роль её заключается также в пополнении фонда оксалоацетата для цикла Кребса.
Все последующие реакции глюконеогенеза протекают в цитоплазме. Мембрана митохондрий непроницаема для оксалоацетата, и он переносится в цитоплазму в виде других метаболитов: малата или аспартата. В цитоплазме указанные соединения вновь переходят в оксалоацетат. При участии фосфоенолпируваткарбоксикиназы из оксалоацетата образуется фосфоенолпируват (рисунок 16.4, реакция 2).
Фосфоенолпируват в результате обращения ряда реакций гликолиза переходит во фруктозо-1,6-дифосфат. Превращение фруктозо-1,6-дифосфата во фруктозо-6-фосфат катализируетсяфруктозодифосфатазой (рисунок 16.4, реакция 3).
Фруктозо-6-фосфат изомеризуется в глюкозо-6-фосфат. Заключительной реакцией глюконеогенеза является гидролиз глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатазы (рисунок 16.4, реакция 4).
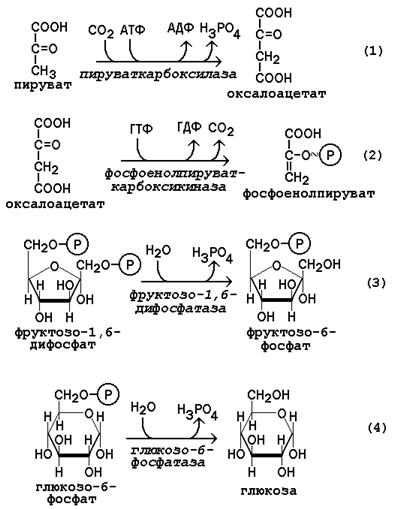
Рисунок 16.4. Обходные реакции глюконеогенеза.
16.2.4. Основными источниками глюкозы в глюконеогенезе являются лактат, аминокислоты, глицерол и метаболиты цикла Кребса.
48. Принципы построения биологических мембран. Роль основных компонентов (липидов, белков, углеводов) в структурной организации и функционировании мембран.
Биологические мембраны – сложные надмолекулярные структуры, окружающие все живые клетки и образующие в них замкнутые, специализированные компартменты – органеллы.
Основные разновидности биологических мембран представлены на рисунке 9.2. Мембрану, ограничивающую цитоплазму клетки снаружи, называют цитоплазматической или плазматической мембраной (1). Название внутриклеточных мембран обычно происходит от названия ограничиваемых или образуемых ими субклеточных структур. Различают ядерную (2), митохондриальную (3), лизосомальную (4) мембраны, мембраны комплекса Гольджи (5), эндоплазматический ретикулум (6) и другие.
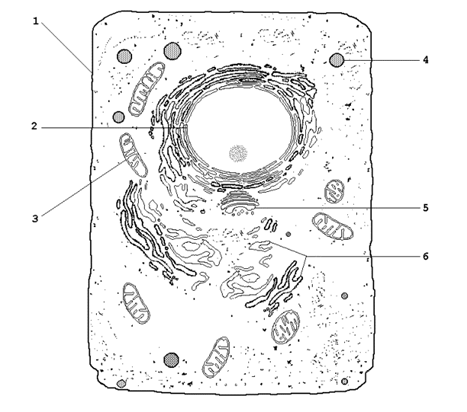
Рисунок 9.2. Схематическое изображение органелл животной клетки (объяснения в тексте).
9.2.2. Некоторые примеры функций биологических мембран.
Плазматическая мембрана – ограничивает содержимое клетки от внешней среды; осуществляет контакт с другими клетками, получение, обработку и передачу информации внутрь клетки, поддержание постоянства внутренней среды.
Ядерные мембраны (внешняя и внутренняя) – образуют ядерную оболочку, которая отделяет хромосомный материал от цитоплазматических органелл; через поры ядерной оболочки происходит транспорт белков и нуклеиновых кислот в ядро и из ядра.
Митохондриальные мембраны – осуществляют преобразование энергии в ходе окислительного фосфорилирования, синтез АТФ.
Лизосомальные мембраны – ограничивают гидролитические ферменты от цитоплазмы клетки, препятствуют самоперевариванию (аутолизу) клеток, способствуют поддержанию постоянства рН среды в лизосомах.
Мембраны эндоплазматического ретикулума – принимают участие в образовании новых мембран, осуществляют синтез белков, липидов, полисахаридов, окисление гидрофобных метаболитов и ксенобиотиков.
Все мембраны по своей организации и составу обнаруживают ряд общих свойств. Они:
- состоят из липидов, белков и углеводов;
- являются плоскими замкнутыми структурами;
- имеют внутреннюю и внешнюю поверхности (асимметричны);
- избирательно проницаемы.
9.3.2. Схема строения биологической мембраны, представлена на рисунке 9.3. Основу мембраны составляет липидный бислой – двойной слой молекул липидов, которые обладают свойствомамфифильности (содержат как гидрофильные, так и гидрофобные функциональные группы). В липидном бислое гидрофобные участки молекул взаимодействуют между собой, а гидрофильные участки обращены в окружающую водную среду.
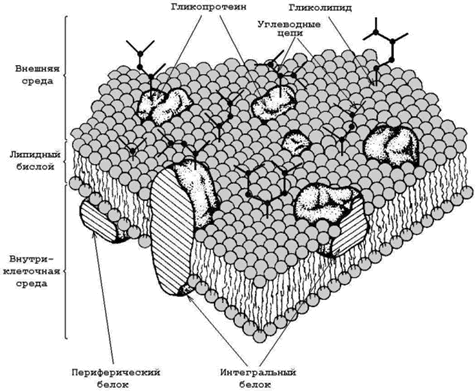
Рисунок 9.3. Схема строения биологической мембраны (по Сингеру и Николсону).
Мембранные липиды выполняют роль растворителя мембранных белков, создавая жидкую среду, в которой они могут функционировать. По степени влияния на структуру бислоя и по силе взаимодействия с ним мембранные белки делят на интегральные и периферические. Важнейшие особенности интегральных и периферических белков представлены в таблице 9.1.
Таблица 9.1
Характеристика мембранных белков
| Интегральные белки | Периферические белки |
|---|---|
| Глубоко внедрены в мембранную структуру и не могут быть удалены из мембраны без её разрушения. | Локализованы на поверхности бислоя и экстрагируются растворами солей или просто водой. |
| Амфифильные глобулярные структуры, центральная погружённая часть – гидрофобна, концевые участки – гидрофильны. | Глобулярные гидрофильные структуры. |
| Удерживаются в липидном бислое за счёт гидрофобных взаимодействий с углеводородными цепочками жирных кислот. | Удерживаются на поверхности бислоя за счёт ионных взаимодействий с полярными участками фосфолипидов и интегральных белков. |
По выполняемым функциям белки в составе мембран делятся на
- структурные;
- каталитические;
- рецепторные;
- транспортные.
Количество белков в мембранах могут существенно отличаться. Например, в миелиновой мембране, предназначенной для изоляции нервных волокон, белки составляют только 25% массы мембраны, а в мембранах митохондрий, связанных с процессами окислительного фосфорилирования, на долю белков приходится около 75% массы. В плазматической мембране доля белков и липидов примерно одинаковы.
Углеводы в составе мембран не представлены самостоятельными соединениями, а обнаруживаются только в соединении с белками (гликопротеины) или липидами (гликолипиды). Длина углеводных цепей колеблется от двух до восемнадцати остатков моносахаридов. Большая часть углеводов расположена на наружной поверхности плазматической мембраны. Функции углеводов в биомембранах – контроль за межклеточными взаимодействиями, поддержание иммунного статуса, рецепция, обеспечение стабильности белковых молекул в мембране.
49. Липиды-амфипаты: представители, способность к агрегации, образованию мицелл, бислоев. Полярные липиды как компоненты биомембран и липопротеинов.
Как уже упоминалось (9.1), компонентами липидов являются остатки жирных кислот и одно- или многоатомных спиртов. Примеры жирных кислот, встречающихся в составе липидов мембран, представлены на рисунке 9.4. Выучите эти формулы.

Рисунок 9.4. Наиболее часто встречающиеся природные жирные кислоты.
Основные особенности строения жирных кислот, входящих в состав природных жиров:
- они содержат чётное число атомов углерода (С16 – С20);
- двойная связь в ненасыщенных жирных кислотах располагается между 9 и 10 атомами углерода;
- в полиненасыщенных жирных кислотах двойные связи разделены метиленовыми группами (СН=CH-CH2-CH=CH), то есть являются несопряжёнными;
- двойные связи находятся в цис-конформации, что приводит к изгибу углеводородной цепи.
9.4.2. Большинство липидов в мембранах млекопитающих представлены фосфолипидами, гликосфинголипидами и холестеролом.
Фосфолипиды в составе мембран подразделяются на две группы: глицерофосфолипиды и сфингомиелины.
Глицерофосфолипиды – представляют собой сложные эфиры трёхатомного спирта глицерола, двух остатков жирных кислот и фосфорилированного аминоспирта. Общая формула глицерофосфолипида представлена на рисунке 9.5.
Наиболее распространённым глицерофосфолипидом мембран является фосфатидилхолин:
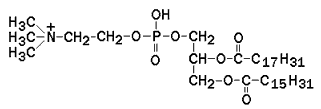
В глицерофосфолипидах у второго углеродного атома глицерола обязательно находится остаток ненасыщенной жирной кислоты (в данном случае линолевой).
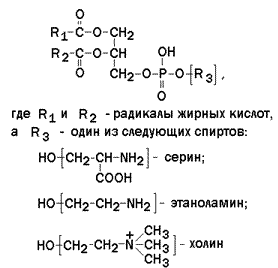
Рисунок 9.5. Общая формула глицерофосфолипидов.
Сфингофосфолипиды (сфингомиелины) являются производными аминоспирта сфингозина (рисунок 9.6). Соединение сфингозина и жирной кислоты получило название церамид.

Рисунок 9.6. Структурные формулы сфингозина и его производных.
В сфингомиелинах водород гидроксильной группы у первого углеродного атома в церамиде замещён на фосфохолин. Пример сфингомиелина, содержащего остаток олеиновой кислоты:
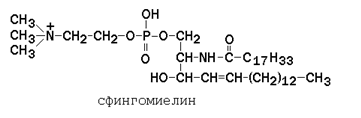
Гликолипиды также являются производными церамида, содержащими один или несколько остатков моносахаридов. Например, цереброзиды содержат в первом положении остаток глюкозы или галактозы:
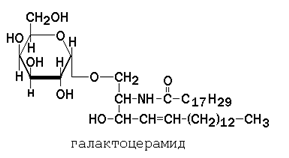
а ганглиозиды содержат цепочку из нескольких остатков сахаров, одним из которых обязательно является сиаловая кислота.
Холестерол (рисунок 9.7) – одноатомный циклический спирт. Это один из главных компонентов плазматической мембраны клеток млекопитающих, в меньшем количестве может присутствовать также в митохондриях, мембранах комплекса Гольджи, ядерных мембранах. Особенно много его в нервной ткани.
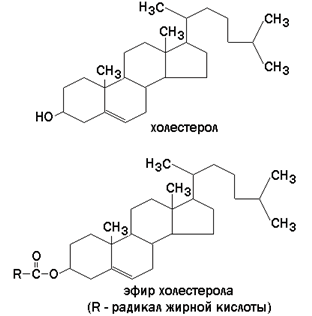
Рисунок 9.7. Структурные формулы холестерола и его эфира.
9.4.3. Как уже было сказано, характерной особенностью мембранных липидов является их амфифильность – наличие в молекуле одновременно гидрофобных и гидрофильных участков. Гидрофобная часть молекулы представлена остатками жирных кислот и боковой цепью сфингозина.
Гидрофильные участки представлены в фосфолипидах фосфорилированным спиртом, а в гликолипидах – остатками сахаров. Амфифильность холестерола выражена слабо – циклическая структура и боковой радикал гидрофобны, и только гидроксильная группа гидрофильна.
Амфифильность мембранных липидов определяет характер их поведения в водной среде. Слипание гидрофобных участков молекул приводит к образованию упорядоченных замкнутых структур – мицелл, в которых гидрофобные области защищены от воды, а гидрофильные обращены в водную среду.
Молекулы холестерола встраиваются между радикалами жирных кислот гидрофобной части бислоя, а его гидроксильная группа примыкает к гидрофильным головкам фосфолипидов. Такая структура, стабилизированная нековалентными гидрофобными взаимодействиями, термодинамически очень устойчива и лежит в основе формирования биологических мембран.
9.4.4. Замкнутый липидный бислой определяет основные свойства мембран:
1) текучесть – зависит от соотношения насыщенных и ненасыщенных жирных кислот в составе мембранных липидов. Гидрофобные цепочки насыщенных жирных кислот ориентированы параллельно друг другу и образуют жёсткую кристаллическую структуру (рисунок 9.8, а). Ненасыщенные жирные кислоты, имеющие изогнутую углеводородную цепь, нарушают компактность упаковки и придают мембране бóльшую жидкостность (рисунок 9.8, б). Холестерол, встраиваясь между жирными кислотами, уплотняет их и повышает жёсткость мембран.
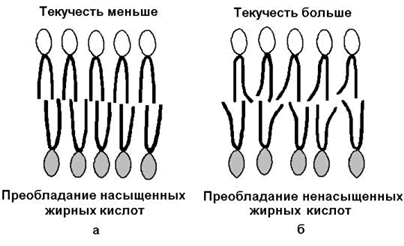
Рисунок 9.8. Влияние жирнокислотного состава фосфолипидов на текучесть липидного бислоя.
2) латеральная диффузия – свободное перемещение молекул относительно друг друга в плоскости мембран (рисунок 9.9,а).
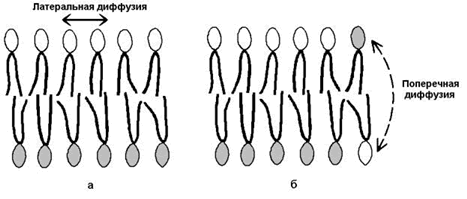
Рисунок 9.9. Виды перемещений фосфолипидных молекул в липидном бислое.
3) ограниченная способность к поперечной диффузии (переходу молекул из наружного слоя во внутренний и наоборот, см. рисунок 9.9, б), что способствует сохранению асимметрии – структурно-функциональных различий наружного и внутреннего слоёв мембраны.
4) непроницаемость замкнутого бислоя для большинства водорастворимых молекул.
50. Транспорт веществ через мембраны. Механизмы переноса веществ. Транспортные АТФазы. Роль К+,Na+-АТФазы в поддержании трансмембранного потенциала и возбудимости мембраны.
Одна из главных функций мембран – участие в переносе веществ. Этот процесс обеспечивается при помощи трёх основных механизмов: простой диффузией, облегчённой диффузией и активным транспортом (рисунок 9.10). Запомните важнейшие особенности этих механизмов и примеры транспортируемых веществ в каждом случае.
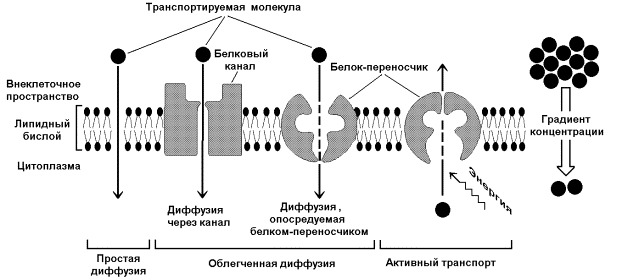
Рисунок 9.10. Механизмы транспорта молекул через мембрану
Простая диффузия - перенос веществ через мембрану без участия специальных механизмов. Транспорт происходит по градиенту концентрации без затраты энергии. Путём простой диффузии транспортируются малые биомолекулы – Н2О, СО2, О2, мочевина, гидрофобные низкомолекулярные вещества. Скорость простой диффузии пропорциональна градиенту концентрации.
Облегчённая диффузия - перенос веществ через мембрану при помощи белковых каналов или специальных белков-переносчиков. Осуществляется по градиенту концентрации без затраты энергии. Транспортируются моносахариды, аминокислоты, нуклеотиды, глицерол, некоторые ионы. Характерна кинетика насыщения – при определённой (насыщающей) концентрации переносимого вещества в переносе принимают участие все молекулы переносчика и скорость транспорта достигает предельной величины.
Активный транспорт – также требует участия специальных белков-переносчиков, но перенос происходит против градиента концентрации и поэтому требует затраты энергии. При помощи этого механизма через клеточную мембрану транспортируются ионы Na+, K+, Ca2+, Mg2+, через митохондриальную – протоны. Для активного транспорта веществ характерна кинетика насыщения.
9.5.2. Примером транспортной системы, осуществляющей активный транспорт ионов, является Na+,K+-аденозинтрифосфатаза (Na+,K+-АТФаза или Na+,K+-насос). Этот белок находится в толще плазматической мембраны и способен катализировать реакцию гидролиза АТФ. Энергия, выделяемая при гидролизе 1 молекулы АТФ, используется для переноса 3 ионов Na+ из клетки во внеклеточное пространство и 2 ионов К+ в обратном направлении (рисунок 9.11). В результате действия Na+,K+-АТФазы создаётся разность концентраций между цитозолем клетки и внеклеточной жидкостью. Поскольку перенос ионов неэквивалентен, то возникает разность электрических потенциалов. Таким образом, возникает электрохимический потенциал, который складывается из энергии разности электрических потенциалов Δφ и энергии разности концентраций веществ ΔС по обе стороны мембраны.
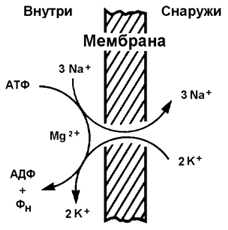
Рисунок 9.11. Схема Na+, K+-насоса.
9.5.3. Перенос через мембраны частиц и высокомолекулярных соединений
Наряду с транспортом органических веществ и ионов, осуществляемым переносчиками, в клетке существует совершенно особый механизм, предназначенный для поглощения клеткой и выведения из неё высокомолекулярных соединений при помощи изменения формы биомембраны. Такой механизм называют везикулярным транспортом.
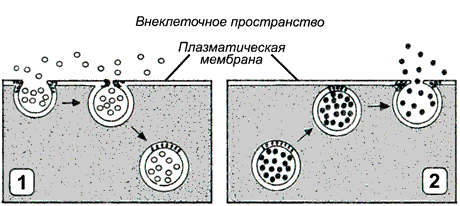
Рисунок 9.12. Типы везикулярного транспорта: 1 - эндоцитоз; 2 - экзоцитоз.
При переносе макромолекул происходит последовательное образование и слияние окружённых мембраной пузырьков (везикул). По направлению транспорта и характеру переносимых веществ различают следующие типы везикулярного транспорта:
Эндоцитоз (рисунок 9.12, 1) — перенос веществ в клетку. В зависимости от размера образующихся везикул различают:
а) пиноцитоз — поглощение жидкости и растворённых макромолекул (белков, полисахаридов, нуклеиновых кислот) с помощью небольших пузырьков (150 нм в диаметре);
б) фагоцитоз — поглощение крупных частиц, таких, как микроорганизмы или обломки клеток. В этом случае образуются крупные пузырьки, называемые фагосомами диаметром более 250 нм.
Пиноцитоз характерен для большинства эукариотических клеток, в то время как крупные частицы поглощаются специализированными клетками - лейкоцитами и макрофагами. На первой стадии эндоцитоза вещества или частицы адсорбируются на поверхности мембраны, этот процесс происходит без затраты энергии. На следующей стадии мембрана с адсорбированным веществом углубляется в цитоплазму; образовавшиеся локальные впячивания плазматической мембраны отшнуровываются от поверхности клетки, образуя пузырьки, которые затем мигрируют внутрь клетки. Этот процесс связан системой микрофиламентов и является энергозависимым. Поступившие в клетку пузырьки и фагосомы могут сливаться с лизосомами. Содержащиеся в лизосомах ферменты расщепляют вещества, содержащиеся в пузырьках и фагосомах до низкомолекулярных продуктов (аминокислот, моносахаридов, нуклеотидов), которые транспортируются в цитозоль, где они могут быть использованы клеткой.
Экзоцитоз (рисунок 9.12, 2) — перенос частиц и крупных соединений из клетки. Этот процесс, как и эндоцитоз, протекает с поглощением энергии. Основными разновидностями экзоцитоза являются:
а) секреция - выведение из клетки водорастворимых соединений, которые используются или воздействуют на другие клетки организма. Может осуществляться как неспециализированными клетками, так и клетками эндокринных желёз, слизистой желудочно-кишечного тракта, приспособленными для секреции производимых ими веществ (гормонов, нейромедиаторов, проферментов) в зависимости от определённых потребностей организма.
Секретируемые белки синтезируются на рибосомах, связанных с мембранами шероховатого эндоплазматического ретикулума. Затем эти белки транспортируются к аппарату Гольджи, где они модифицируются, концентрируются, сортируются, и затем упаковываются в пузырьки, которые отщепляются в цитозоль и в дальнейшем сливаются с плазматической мембраной, так что содержимое пузырьков оказывается вне клетки.
В отличие от макромолекул, секретируемые частицы малых размеров, например, протоны, транспортируются из клетки при помощи механизмов облегчённой диффузии и активного транспорта.
б) экскреция - удаление из клетки веществ, которые не могут быть использованы (например, удаление в ходе эритропоэза из ретикулоцитов сетчатой субстанции, представляющей собой агрегированные остатки органелл). Механизм экскреции, по-видимому, состоит в том, что вначале выделяемые частицы оказываются в цитоплазматическом пузырьке, который затем сливается с плазматической мембраной.
51. Окисление высших жирных кислот. Последовательность реакций b-окисления. Связь окисления жирных кислот с цитратным циклом и дыхательной цепью. Биологическая роль.
β-Окисление - специфический путь катаболизма жирных кислот, при котором от карбоксильного конца жирной кислоты последовательно отделяется по 2 атома углерода в виде ацетил-КоА. Метаболический путь - β-окисление - назван так потому, что реакции окисления жирной кислоты происходят у β-углеродного атома. Реакции β-окисления и последующего окисления ацетил-КоА в ЦТК служат одним из основных источников энергии для синтеза АТФ по механизму окислительного фосфорилирования. β-Окисление жирных кислот происходит только в аэробных условиях.
Активация жирных кислот
Перед тем, как вступить в различные реакции, жирные кислоты должны быть активированы, т.е. связаны макроэргической связью с коферментом А:
RCOOH + HSKoA + АТФ → RCO ~ КоА + АМФ + PPi.
Реакцию катализирует фермент ацил-КоА син-тетаза. Выделившийся в ходе реакции пирофосфат гидролизуется ферментом пирофосфатазой: Н4Р2О7 + Н2О → 2 Н3РО4.
Выделение энергии при гидролизе макроэргической связи пирофосфата смещает равновесие реакции вправо и обеспечивает полноту протекания реакции активации.
Ацил-КоА синтетазы находятся как в цитозоле, так и в матриксе митохондрий. Эти ферменты отличаются по специфичности к жирным кислотам с различной длиной углеводородной цепи. Жирные кислоты с короткой и средней длиной цепи (от 4 до 12 атомов углерода) могут проникать в матрикс митохондрий путём диффузии. Активация этих жирных кислот происходит в матриксе митохондрий. Жирные кислоты с длинной цепью, которые преобладают в организме человека (от 12 до 20 атомов углерода), активируются ацил-КоА синтетазами, расположенными на внешней мембране митохондрий.
Транспорт жирных кислот с длинной углеводородной цепью в митохондриях
β-Окисление жирных кислот, происходит в матриксе митохондрий, поэтому после активации жирные кислоты должны транспортироваться внутрь митохондрий. Жирные кислоты с длинной углеводородной цепью переносятся через плотную внутреннюю мембрану митохондрий с помощью карнитина. Карнитин поступает с пищей или синтезируется из незаменимых аминокислот лизина и метионина. В реакциях синтеза карнитина участвует витамин С (аскорбиновая кислота).
В наружной мембране митохондрий находится фермент карнитинацилтрансфераза I (карнитин-пальмитоилтрансфераза I), катализирующий реакцию с образованием ацилкарнитина.
Образовавшийся ацилкарнитин проходит через межмембранное пространство к наружной стороне внутренней мембраны и транспортируется с помощью карнитинацилкарнитинтранс-локазы на внутреннюю поверхность внутренней мембраны митохондрий, где фермент карнитинацилтрансфераза II катализирует перенос ацила на внутримитохондриальный КоА (рис. 8-26). Таким образом, ацил-КоА становится доступным для ферментов β-окисления. Свободный карнитин возвращается на цитозольную сторону внутренней
400

Рис. 8-26. Перенос жирных кислот с длинным углеводородным радикалом через мембраны митохондрий.Фермент карнитинацилтрансфераза I - регуляторный фермент β-окисления; ингибируется малонил-КоА - промежуточным метаболитом, образующимся при биосинтезе жирных кислот. * - карнитинацилкарнитинтранслоказа.
мембраны митохондрий той же транслоказой.
На внутренней поверхности внутренней мембраны находится фермент карнитинацил трансфераза II, катализирующий обратный перенос ацила с карнитина на внутримитохондриальный КоА. После этого ацил-КоА включается в реакции β-окисления.
β-Окисление жирных кислот - специфический путь катаболизма жирных кислот, протекающий в матриксе митохондрий только в аэробных условиях и заканчивающийся образованием ацетил-КоА. Водород из реакций β-окисления поступает в ЦПЭ, а ацетил-КоА окисляется в цитратном цикле, также поставляющем водород для ЦПЭ. Поэтому β-окисление жирных кислот - важнейший метаболический путь, обеспечивающий синтез АТФ в дыхательной цепи.
β-Окисление начинается с дегидрирования ацил-КоА FAD-зависимой ацил-КоА дегидрогеназой с образованием двойной связи между α- и β-атомами углерода в продукте реакции - еноил-КоА. Восстановленный в этой реакции кофермент FADH2 передаёт атомы водорода в ЦПЭ на кофермент Q. В результате синтезируются 2 молекулы АТФ (рис. 8-27). В следующей реакции р-окисления по месту двойной связи присоединяется молекула воды таким образом, что ОН-группа находится у β-углеродного атома ацила, образуя β-гидроксиацил-КоА. Затем β-гидроксиацил-КоА окисляется NАD+-зависимой дегидрогеназой. Восстановленный NADH, окисляясь в ЦПЭ, обеспечивает энергией синтез 3 молекул АТФ. Образовавшийся β-кетоацил-КоА подвергается тиолитическому расщеплению ферментом тиолазой, так как по месту разрыва связи С-С через атом серы присоединяется молекула кофермента А. В результате этой последовательности из 4 реакций от ацил-КоА отделяется двухуглеродный остаток - ацетил-КоА. Жирная кислота, укороченная на 2 атома углерода, опять проходит реакции дегидрирования, гидратации, дегидрирования, отщепления ацетил-КоА. Эту последовательность реакций обычно называют "циклом β-окисления", имея в виду, что одни и те же реакции повторяются с радикалом жирной кислоты до тех пор, пока вся кислота не превратится в ацетильные остатки.
52. Биосинтез жирных кислот в тканях: последовательность реакций, биологическая роль. Компартментализация и регуляция обмена жирных кислот.
Высшие жирные кислоты могут быть синтезированы в организме из метаболитов углеводного обмена. Исходным соединением для этого биосинтеза является ацетил-КоА, образующийся в митохондриях из пирувата – продукта гликолитического распада глюкозы. Место синтеза жирных кислот – цитоплазма клеток, где имеется мультиферментный комплекссинтетаза высших жирных кислот. Этот комплекс состоит из шести ферментов, связанных с ацилпереносящим белком, который содержит две свободные SH-группы (АПБ-SH). Синтез происходит путём полимеризации двууглеродных фрагментов, конечным продуктом его является пальмитиновая кислота – насыщенная жирная кислота, содержащая 16 атомов углерода. Обязательными компонентами, участвующими в синтезе, являются НАДФН (кофермент, образующийся в реакциях пентозофосфатного пути окисления углеводов) и АТФ.
20.1.2. Ацетил-КоА поступает из митохондрий в цитоплазму при помощи цитратного механизма (рисунок 20.1). В митохондриях ацетил-КоА взаимодействует с оксалоацетатом (фермент –цитратсинтаза), образующийся цитрат переносится через митохондриальную мембрану при помощи специальной транспортной системы. В цитоплазме цитрат реагирует с HS-КоА и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат (фермент – цитратлиаза).
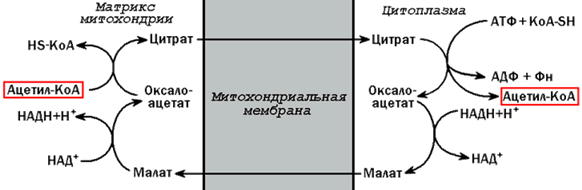
Рисунок 20.1. Перенос ацетильных групп из митохондрий в цитоплазму.
20.1.3. Начальной реакцией синтеза жирных кислот является карбоксилирование ацетил-КоА с образованием малонил-КоА (рисунок 20.2). Фермент ацетил-КоА-карбоксилаза активируется цитратом и ингибируется КоА-производными высших жирных кислот.

Рисунок 20.2. Реакция карбоксилирования ацетил-КоА.
Затем ацетил-КоА и малонил-КоА взаимодействуют с SH-группами ацилпереносящего белка (рисунок 20.3).
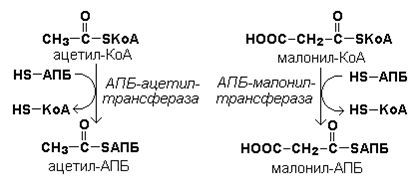
Рисунок 20.3. Взаимодействие ацетил-КоА и малонил-КоА с ацилпереносящим белком.
Далее происходит их конденсация, декарбоксилирование и восстановление образовавшегося продукта (рисунок 20.4).
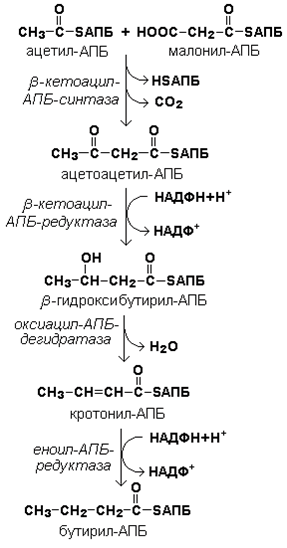
Рисунок 20.4. Реакции одного цикла биосинтеза жирных кислот.
Продукт реакции взаимодействует с новой молекулой малонил-КоА и цикл многократно повторяется вплоть до образования остатка пальмитиновой кислоты.
20.1.4. Запомните основные особенности биосинтеза жирных кислот по сравнению с β-окислением:
- синтез жирных кислот в основном осуществляется в цитоплазме клетки, а окисление – в митохондриях;
- участие в процессе связывания СО2 с ацетил-КоА;
- в синтезе жирных кислот принимает участие ацилпереносящий белок, а в окислении – коэнзим А;
- для биосинтеза жирных кислот необходимы окислительно-восстановительные коферменты НАДФН, а для β-окисления – НАД+ и ФАД.
53. Биосинтез ацилглицеролов и фосфолипидов: последовательность реакций, значение. Липотропный эффект фосфолипидов, роль в предупреждении жирового перерождения печени.
Биосинтез триацилглицеролов и глицерофосфолипидов происходит в цитоплазме клеток. Первые реакции этих метаболических путей совпадают и включают образование фосфатидной кислоты.
Предшественники фосфатидной кислоты - глицерол и жирные кислоты - вступают в реакцию в активной форме.
Образование активной формы глицерола (глицерол-3-фосфата может происходить двумя путями (рисунок 21.1).
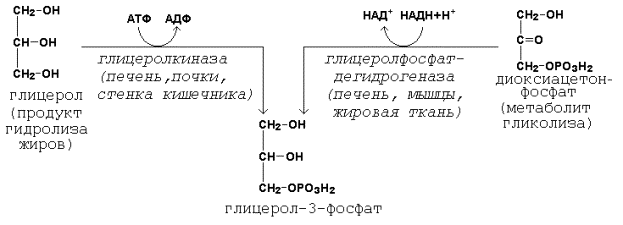
Рисунок 20.5. Пути образования глицерол-3-фосфата.
Активация жирных кислот идёт путём образования тиоэфиров коэнзима А – ацил-КоА (см. 19.3.1, рисунок 19.7).
20.2.2. Первая реакция ацилирования глицерол-3-фосфата осуществляется за счёт КоА-производного насыщенной жирной кислоты, например, пальмитиновой. Образуется сложноэфирная связь в 1-м положении (рисунок 20.6, реакция 1).
Вторая реакция ацилирования идёт, как правило, за счёт КоА-тиоэфира ненасыщенной жирной кислоты, например, олеиновой (рисунок 20.6, реакция 2).
В процессе синтеза триацилглицеролов происходит дефосфорилирование фосфатидной кислоты при помощи фосфатидатфосфатазы (рисунок 20.6, реакция 3).
В дальнейшем 1,2-диацилглицерол ацилируется третьей молекулой ацил-КоА, которая может содержать остаток как ненасыщенной, так и насыщенной жирной кислоты (рисунок 20.6, реакция 4).
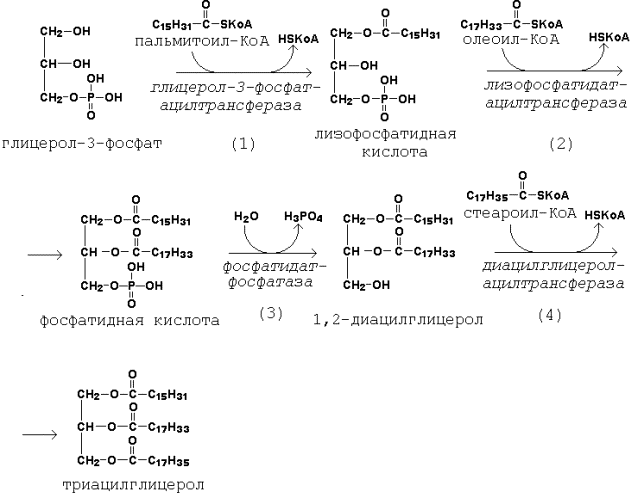
Рисунок 20.6. Реакции биосинтеза триацилглицеролов.
20.2.3. В организме здорового человека процессы биосинтеза и катаболизма триацилглицеролов взаимно уравновешены.
В тех случаях, когда углеводы, жиры или белки потребляются в количествах, превышающих энергетические потребности организма, излишки калорий запасаются в виде триацилглицеролов. Источником ацетил-КоА для биосинтеза жирных кислот могут служить как углеводы, так и углеродные цепи аминокислот. Накопленный избыток жиров может быть израсходован для получения энергии, например, при голодании.
Скорость биосинтеза триацилглицеролов регулируется гормонами. Инсулин стимулирует поступление глюкозы в клетки и, следовательно, превращение её в жиры. Глюкагон и гормоны надпочечников тормозят этот процесс.
ак известно (18.4.2), глицерофосфолипиды являются производными фосфатидной кислоты и одного из аминоспиртов (например, этаноламина, холина или серина). Реакции образования фосфатидной кислоты обсуждались в предыдущем параграфе (см. 20.2.2, рисунок 20.6).
Подобно другим предшественникам в биосинтезе липидов, аминоспирты, участвующие в синтезе фосфолипидов, вступают в реакцию в активной форме – в виде соединения с цитидиндифосфатом (ЦДФ). В качестве примера на рисунке 20.7 приводятся реакции активации этаноламина. Обратите внимание, что в реакциях активации аминоспиртов принимают участие два нуклеозидтрифосфата – АТФ и ЦТФ.
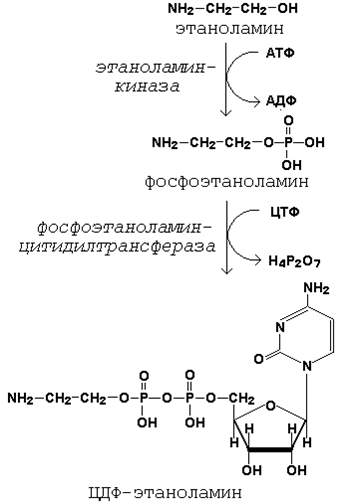
Рисунок 20.7. Реакции образования активной формы этаноламина.
Далее остаток фосфоэтаноламина с ЦДФ-этаноламина переносится на 1,2-диацилглицерол, образующийся в результате дефосфорилирования фосфатидной кислоты (рисунок 20.8, реакции 1 и 2). Продуктом реакции является фосфатидилэтаноламин.
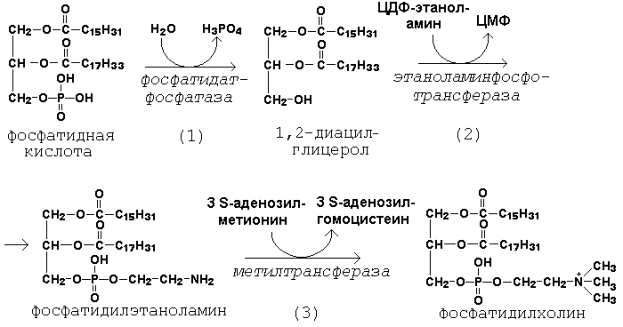
Рисунок 20.8. Реакции синтеза фосфатидилхолина.
Синтез фосфатидилхолина происходит путём трёхкратного метилирования фосфатидидэтаноламина. Донором метильных групп служит S-аденозилметионин (рисунок 20.8, реакция 3). Фосфатидилхолин может образоваться также путём активации холина, подобно этаноламину.
Фосфатидилсерин образуется в реакции прямого взаимодействия фосфатидилэтаноламина и серина:
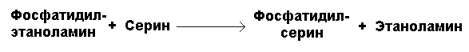
20.3.2. Липотропные факторы – вещества, способствующие синтезу фосфолипидов и препятствующие отложению триацилглицеролов в тканях.
Липотропный эффект этих соединений связан с тем, что общим предшественником триацилглицеролов и фосфолипидов является фосфатидная кислота. При недостатке липотропных факторов фосфатидная кислота используется преимущественно для синтеза триацилглицеролов. Они нерастворимы в воде и накапливаются в клетках, способствуя их жировому перерождению. Запомните, какие липотропные факторы можно использовать в качестве препаратов для его предупреждения:
1) холин – самое распространённое азотистое основание фосфолипидов;
2) метионин – незаменимая аминокислота, предшественник S-аденозилметионина, универсального донора метильных групп;
3) фолиевая кислота и витамин В12 – предшественники коферментов, участвующих в реакциях переноса СН3-групп.
При введении липотропных факторов снижается синтез триацилглицеролов и усиливается выведение жира из клеток при участии липопротеиновых комплексов (см.21.5.2).
54. Биосинтез и использование кетоновых тел. Гиперкетонемия: причины механизм развития и последствия.
При голодании, длительной физической работе и в случаях, когда клетки не получают достаточного количества глюкозы, жирные кислоты
405

Рис. 8-31. ω-Окисление жирных кислот. ω-Окисление жирных кислот активируется в тех случаях, когда активность β-окисления жирных кислот снижена. 1 - адипиновая кислота; 2 - субериновая кислота.
используются многими тканями как основной источник энергии. В отличие от других тканей мозг и другие отделы нервной ткани практически не используют жирные кислоты в качестве источника энергии. В печени часть жирных кислот превращается в кетоновые тела, которые окисляются мозгом, нервной тканью, мышцами, обеспечивая достаточное количество энергии для синтеза АТФ и уменьшая потребление глюкозы. К кетоновым телам относят β-гидроксибутират, ацетоацетат и ацетон. Первые две молекулы могут окисляться в тканях, обеспечивая синтез АТФ. Ацетон образуется только при высоких концентрациях кетоновых тел в крови и, выделяясь с мочой, выдыхаемым воздухом и потом, позволяет организму избавляться от избытка кетоновых тел.
Синтез кетоновых тел в печени. При низком соотношении инсулин/глюкагон в крови в жировой ткани активируется распад жиров. Жирные кислоты поступают в печень в большем количестве, чем в норме, поэтому увеличивается скорость β-окисления (рис. 8-32). Скорость реакций ЦТК в этих условиях снижена, так как оксалоацетат используется для глюконеогенеза. В результате скорость образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА накапливается в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени.
Синтез кетоновых тел начинается с взаимодействия двух молекул ацетил-КоА, которые под действием фермента тиолазы образуют ацетоацетил-КоА (рис. 8-33). С ацетоацетил-КоА взаимодействует третья молекула ацетил-КоА, образуя 3-гидрокси-3-метилглутарил-КоА (ГМГ-КоА). Эту реакцию катализирует фермент ГМГ-КоА-синтаза. Далее ГМГ-КоА-лиаза катализирует расщепление ГМГ-КоА на свободный ацетоацетат и ацетил-КоА.
Ацетоацетат может выделяться в кровь или превращаться в печени в другое кетоновое тело - β-гидроксибутират путём восстановления.
В клетках печени при активном β-окислении создаётся высокая концентрация NADH. Это способствует превращению большей части ацетоацетата в β-гидроксибутират, поэтому основное кетоновое тело в крови - именно β-гидроксибутират. При голодании для многих тканей жирные кислоты и кетоновые тела становятся основными топливными молекулами. Глюкоза используется в первую очередь нервной тканью и эритроцитами.
При высокой концентрации ацетоацетата часть его неферментативно декарбоксилируется, превращаясь в ацетон. Ацетон не утилизируется тканями, но выделяется с выдыхаемым воздухом и мочой. Таким путём организм удаляет избыточное количество кетоновых тел, которые не успевают окисляться, но, являясь водорастворимыми кислотами, вызывают ацидоз.
406

Рис. 8-32. Активация синтеза кетоновых тел при голодании. Точечные линии - скорость метаболических путей снижена; сплошные линии - скорость метаболических путей повышена. При голодании в результате действия глюкагона активируются липолиз в жировой ткани и (3-окисление в печени. Количество оксалоацетата в митохондриях уменьшается, так как он, восстановившись до малата, выходит в цитозоль, где опять превращается в Оксалоацетат и используется в глюконеогенезе. В результате скорость реакций ЦТК снижается и, соответственно, замедляется окисление ацетил-КоА. Концентрация ацетил-КоА в митохондриях увеличивается, и активируется синтез кетоновых тел. Синтез кетоновых тел увеличивается также при сахарном диабете (см. раздел 11).
407

Рис. 8-33. Синтез кетоновых тел в митохондриях гепатоцитов. Регуляторный фермент синтеза кетоновых тел (ГМГ-КоА-синтаза) ингибируется свободным КоА. - реакция идёт неферментативно при высокой концентрации кетоновых тел в крови.
Регуляция синтеза кетоновых тел. Регуляторный фермент синтеза кетоновых тел - ГМГ-КоА синтаза.
- ГМГ-КоА-синтаза - индуцируемый фермент; его синтез увеличивается при повышении концентрации жирных кислот в крови. Концентрация жирных кислот в крови увеличивается при мобилизации жиров из жировой ткани под действием глюкагона, адреналина, т.е. при голодании или физической работе.
- ГМГ-КоА-синтаза ингибируется высокими концентрациями свободного кофермента А.
- Когда поступление жирных кислот в клетки печени увеличивается, КоА связывается с ними, концентрация свободного КоА снижается, и фермент становится активным.
- Если поступление жирных кислот в клетки печени уменьшается, то, соответственно, увеличивается концентрация свободного КоА, ингибирующего фермент. Следовательно, скорость синтеза кетоновых тел в печени зависит от поступления жирных кислот.
Окисление кетоновых тел в периферических тканях
При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек. Таким образом
408
глюкоза сохраняется для окисления в мозге и эритроцитах. Уже через 2-3 дня после начала голодания концентрация кетоновых тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе.
β-Гидроксибутират (рис. 8-34), попадая в клетки, дегидрируется NAD-зависимой дегидрогеназой и превращается в ацетоацетат. Ацетоацетат активируется, взаимодействуя с сук-цинил-КоА - донором КоА:
Ацетоацетат + Сукцинил-КоА → Ацетоацетил- КоА + Сукцинат.

Рис. 8-34. Окисление кетоновых тел в тканях.
Реакцию катализирует сукцинил-КоА-ацето-ацетат-КоА-трансфераза. Этот фермент не синтезируется в печени, поэтому печень не использует кетоновые тела как источники энергии, а производит их "на экспорт". Кетоновые тела - хорошие топливные молекулы; окисление одной молекулы β-гидроксибутирата до СО2 и Н2О обеспечивает синтез 27 молекул АТФ. Эквивалент одной макроэргической связи АТФ (в молекуле сукцинил-КоА) используется на активацию ацетоацетата, поэтому суммарный выход АТФ при окислении одной молекулы β-гидроксибутирата - 26 молекул.
Кетоацидоз. В норме концентрация кетоновых тел в крови составляет 1-3 мг/дл (до 0,2 мМ/л), но при голодании значительно увеличивается. Увеличение концентрации кетоновых тел в крови называют кетонемией, выделение кетоновых тел с мочой - кетонурией. Накопление кетоновых тел в организме приводит к кетоацидозу: уменьшению щелочного резерва (компенсированному ацидозу), а в тяжёлых случаях - к сдвигу рН (некомпенсированному ацидозу), так как кетоновые тела (кроме ацетона) являются водорастворимыми органическими кислотами (рК~3,5), способными к диссоциации:
СН3-СО-СН2-СООН ↔ СН3-СО-СН2-СОО- + Н+.
Ацидоз достигает опасных величин при сахарном диабете, так как концентрация кетоновых тел при этом заболевании может доходить до 400-500 мг/дл. Тяжёлая форма ацидоза - одна из основных причин смерти при сахарном диабете. Накопление протонов в крови нарушает связывание кислорода гемоглобином, влияет на ионизацию функциональных групп белков, нарушая их кон-формацию и функцию.
55. Обмен и функции холестерола. Нарушения обмена холестерола.
Исходным соединением для синтеза холестерола является ацетил-КоА (см. 20.2.3, рисунок 20.6). Ферменты, катализирующие реакции синтеза, содержатся в цитоплазме и эндоплазматическом ретикулуме многих клеток. Наиболее активно этот процесс происходит в печени. В организме человека в сутки синтезируется около одного грамма холестерола.
21.1.2. Биосинтез холестерола включает три основные стадии (рисунок 21.1).
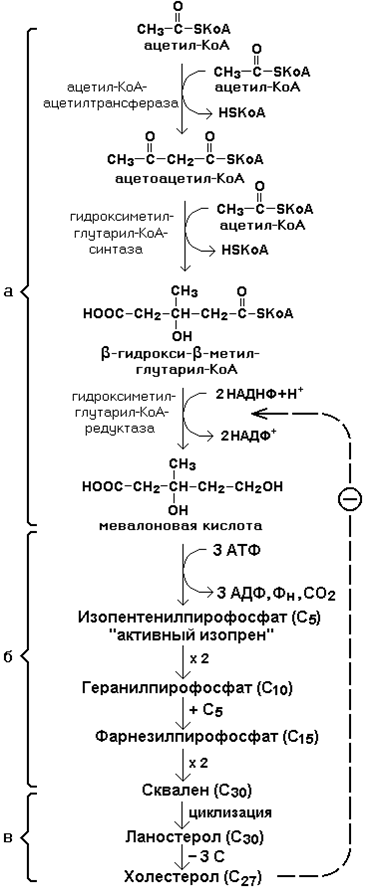
Рисунок 21.1 Синтез холестерола.
На первой стадии образуется мевалоновая кислота (рисунок 21.5, а).
На второй стадии мевалоновая кислота превращается в изопентенилпирофосфат («активный изопрен»), 6 молекул которого конденсируются в сквален (рисунок 21.5, б).
На третьей стадии сквален превращается в холестерол (рисунок 21.5, в).
Всего для синтеза 1 молекулы холестерола используется 18 молекул ацетил-КоА: для образования «активного изопрена» требуется 3 молекулы; в последующих реакциях конденсации участвуют 6 молекул «активного изопрена»; 3 × 6 = 18.
21.1.3. Скорость синтеза холестерола в организме регулируется по механизму отрицательной обратной связи (рисунок 21.5, пунктирная стрелка). Фермент β-гидрокси-β-метилглутарил-КоА-редуктаза катализирует лимитирующую реакцию биосинтеза холестерола. Холестерол является корепрессором синтеза данного ферментного белка, что приводит к снижению скорости катализируемой реакции. Поэтому при поступлении избытка холестерола с пищей синтез эндогенного холестерола прекращается.
Холестерол является компонентом биологических мембран, из него в организме образуются стероидные гормоны, витамин D3, желчные кислоты (см. 14.1.2). Избыток холестерола превращается в печени в желчные кислоты (см. 20.1.3, рисунок 20.3), а также выделяется с желчью в кишечник и выводится с калом.
21.1.4. Нормальное содержание холестерола в сыворотке крови человека составляет 3,9 – 6,3 ммоль/л. Транспортной формой холестерола в крови являются липопротеины (см. далее 21.4.2). Если нарушается соотношение между поступлением холестерола в организм и его выведением, то содержание холестерола в тканях и крови изменяется. Повышение концентрации холестерола в крови (гиперхолестеролемия) может приводить к развитию атеросклероза и желчно-каменной болезни.
Если нарушается соотношение между поступлением холестерола в организм и его выведением, то содержание холестерола в тканях и крови изменяется. Повышение концентрации холестерола в крови (гиперхолестеролемия) может приводить к развитию атеросклероза и желчно-каменной болезни.
21.3.2. Атеросклероз относится к широко распространенным заболеваниям, которые связывают с развитием в организме гиперлипопротеинемии и сопровождающей ее гиперхолестеролемии. Установлено, что при атеросклерозе в плазме крови повышается содержание фракции ЛПНП, а чаще всего и фракции ЛПОНП, которые относят к атерогенным фракциям, в то время как снижается содержание липопротеинов высокой плотности, которые рассматриваются как антиатерогенные.
Как было отмечено, фракция ЛПНП транспортирует холестерол, синтезированный в печени или клетках кишечного эпителия, в периферические ткани, а фракция ЛПВП осуществляет так называемый обратный транспорт, т. е. удаляет из них холестерол. Как известно, атеросклероз характеризуется отложением холестерола в стенках сосудов, на месте которых со временем образуются утолщения — атеросклеротические бляшки, вокруг которых развивается соединительная ткань (склероз), откладываются соли кальция. Сосуды становятся жесткими, теряют эластичность, ухудшается кровоснабжение тканей, а на месте бляшек могут возникать тромбы.
Антиатерогенная фракция плазмы крови — ЛПВП способна извлекать холестерол из клеточных мембран и фракции ЛПНП за счет двухстороннего обмена и осуществлять их обратный транспорт — от периферических тканей в печень, где холестерол окисляется в желчные кислоты.
В клинической практике используется расчёт отношения всех атерогенных липопротеинов к антиатерогенным. Отражением этого является коэффициент атерогенности (КА). Отсюда и формула коэффициента:
![]() ,
,
где общий ХС - это весь холестерол, содержащийся в плазме крови, во всех липопротеинах, а ХСЛПВП - это холестерол, входящий в состав антиатерогенных липопротеинов, т.е. "хороший ХС". А разница между общим ХС и "хорошим ХС" и есть весь "плохой ХС". Чем выше значения коэффициента, тем больше плохого ХС и меньше хорошего, и тем выше риск атероклероза. Этот показатель должен быть в пределах от 2 до 2,5. При коэффициенте атерогенности 3-4 имеется умеренная вероятность развития атеросклероза, при величине более 4 - высокая вероятность. У лиц с сильно выраженным атеросклерозом этот коэффициент может достигать 7 и более. При высоких значениях коэффициента атерогенности требуется малохолестероловая диета и лечение препаратами, снижающими уровень холестерола в крови.
21.3.3. Желчнокаменная болезнь. При увеличении относительной концентрации холестерола по сравнению с концентрацией желчных кислот нарушается структура мицелл и создаются условия для перехода холестерола из мицеллярной, устойчивой в растворе формы, в жидкокристаллическую форму, которая в воде неустойчива. При прогрессировании этого процесса в дальнейшем происходит переход холестерола в твердокристаллическую форму, что и приводит к образованию холестериновых камней.
Способность желчи генерировать конкременты, в том числе и преимущественно холестероловой природы, получила название литогенности желчи (от слова lithos - камень). Литогенность желчи можно оценить с помощью биохимических методов исследования. С этой целью в желчи определяют содержание холестерола, желчных кислот (холатов), иногда также определяют содержание фосфатидилхолина. Далее рассчитывают холатно-холестериновый коэффициент, т.е. отношение концентраций желчных кислот и холестерола. У здорового человека значение холатно-холестеринового коэффициента больше 15. Если полученное значение коэффициента менее 15, желчь считается литогенной.
До настоящего времени основным методом лечения желчно-каменной болезни является хирургический. Это или тяжелая операция по удалению желчного пузыря, или же ультразвуковое дробление желчных камней в желчевыводящих путях. Однако начинает применяться и другой метод – постепенное растворение камней с помощью длительного приема хенодезоксихолевой кислоты, от содержания которой в желчи в значительной мере зависит растворимость в ней холестерола. Установлено, что ежедневный прием 1 г хенодезоксихолевой кислоты в течение года может привести к растворению холестеролового камня размером с горошину. Использование хенодезоксихолевой кислоты целесообразно еще и потому, что она оказывает ингибирующее действие на ГМГ-редуктазу в гепатоцитах, снижая тем самым уровень эндогенного синтеза холестерола в организме. Снижение эндогенного синтеза холестерола приводит к уменьшению его концентрации в желчи, что ведет к уменьшению ее литогенности.
56. Липопротеины крови: особенности строения, состава и функций разных классов липопротеинов. Роль в обмене триацилглицеролов и холестерола. Диагностическое значение определения уровня холестерола и липопротеинов в крови.
|
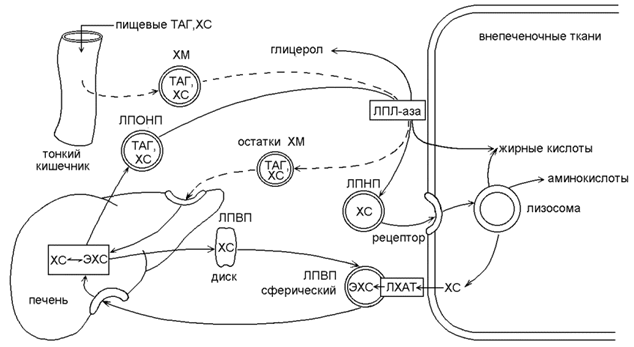
21.2.1. Липиды нерастворимы в воде и поэтому транспортируются кровью в форме надмолекулярных комплексов – липопротеинов. Гидрофобное ядро липопротеинов содержит неполярные липиды (ТАГ, эфиры холестерола), оболочка состоит из амфифильных липидов (фосфолипиды, холестерол) и белков-апопротеинов (см. 15.2.2). Липопротеины различаются по химическому составу, свойствам и функциям. Основными классами липопротеинов являются: 1) хиломикроны, 2) липопротеины очень низкой плотности (ЛПОНП), 3) липопротеины низкой плотности (ЛПНП), 4) липопротеины высокой плотности (ЛПВП). 21.2.2. Особенности обмена и биологическая роль различных классов липопротеинов представлены на рисунке 21.2.
Рисунок 21.2. Обмен липопротеинов. ЛПВП - липопротеин высокой плотности; ЛПНП - липопротеин низкой плотности; ЛПОНП - липопротеин очень низкой плотности; ХМ - хиломикрон; ТГ - триацилглицерол; ХС -холестерол; ЭХС - эфир холестерола; ЛПЛ-аза - липопротеинлипаза; ЛХАТ - лецитин: холестерол-ацилтрансфераза. Хиломикроны (см. также 15.2.2) образуются в стенке кишечника, содержат до 80% ТАГ пищевого происхождения, которые транспортируются кровью в периферические ткани. В кровеносных капиллярах ТАГ подвергаются гидролизу липопротеинлипазой; образующиеся жирные кислоты поступают в ткани, а «остатки» хиломикронов поглощаются клетками печени (рисунок 16.10, пунктирная линия). ЛПОНП - образуются в печени, являются транспортной формой эндогенных ТАГ. Как и хиломикроны, являются субстратами липопротеинлипазы эндотелия капилляров. После гидролиза ТАГ, ЛПОНП превращаются в ЛПНП. ЛПНП - образуются в крови из ЛПОНП под действием липопротеинлипазы. Богаты холестеролом, транспортируют его во внепечёночные ткани. В результате взаимодействия ЛПНП с рецепторами на поверхности мембран холестерол из ЛПНП проникает внутрь клеток, где участвует в образовании клеточных структур и реакциях биосинтеза веществ (см.14.4.1). ЛПВП – образуются в печени, первоначально состоят преимущественно из белков и фосфолипидов и имеют форму дисков. При помощи фермента ЛХАТ липопротеины этого класса извлекают избыток холестерола из внепечёночных клеток и в форме эфиров доставляют его в печень. Увеличение содержания в крови ЛПНП и ЛПОНП и уменьшение содержания ЛПВП способствует развитию атеросклероза. Следовательно, ЛПОНП и ЛПНП – атерогенные липопротеины, ЛПВП –антиатерогенные липопротеины. |
57. Перекисное окисление липидов (ПОЛ) в биомембранах. Субстраты и факторы, способствующие его инициации. Роль ПОЛ в норме и патологии. Арахидоновая кислота как предшественник биологически активных соединений. Биологическая роль витамина Е.
Реакции перекисного окисления липидов (ПОЛ) являются свободнорадикальными и постоянно происходят в организме. Свободнора-дикальное окисление нарушает структуру многих молекул. В белках окисляются некоторые аминокислоты. В результате разрушается структура белков, между ними образуются ковалент-ные "сшивки", всё это активирует протеолитические ферменты в клетке, гидролизующие повреждённые белки. Активные формы кислорода легко нарушают и структуру ДНК. Неспецифическое связывание Fe2+ молекулой ДНК облегчает образование гидроксильных радикалов, которые разрушают структуру азотистых оснований. Но наиболее подвержены действию активных форм кислорода жирные кислоты, содержащие двойные связи, расположенные через СН2-группу. Именно от этой СН2-группы свободный радикал (инициатор окисления) легко отнимает электрон, превращая липид, содержащий эту кислоту, в свободный радикал.
ПОЛ - цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления.
429
Стадии перекисного окисления липидов
1) Инициация: образование свободного радикала (L•)

Инициирует реакцию чаще всего гидроксильный радикал, отнимающий водород от СН2-групп полиеновой кислоты, что приводит к образованию липидного радикала.
2) Развитие цепи:
L • + О2 → LOO •
LOO• + LH → LOOM + LR•
Развитие цепи происходит при присоединении О2, в результате чего образуется липопе-роксирадикал LOO• или пероксид липида LOOH.
ПОЛ представляет собой свободнорадикальные цепные реакции, т.е. каждый образовавшийся радикал инициирует образование нескольких других.
3) Разрушение структуры липидов

Конечные продукты перекисного окисления полиеновых кислот - малоновый диальдегид и гидропероксид кислоты.
4) Обрыв цепи - взаимодействие радикалов между собой:
LOO• + L• → LOOH + LH
L• + vit E → LH + vit E•
vit E• + L• → LH + vit Еокисл.
Развитие цепи может останавливаться при взаимодействии свободных радикалов между собой или при взаимодействии с различными антиоксидантами, например, витамином Е, который отдаёт электроны, превращаясь при этом в стабильную окисленную форму.
В. Повреждение клеток в результате перекрестное окислени лепидов
Активные формы кислорода повреждают структуру ДНК, белков и различные мембранные структуры клеток. В результате появления в гидрофобном слое мембран гидрофильных зон за счёт образования гидропероксидов жирных кислот в клетки могут проникать вода, ионы натрия, кальция, что приводит к набуханию клеток, органелл и их разрушению. Активация перекисного окисления характерна для многих заболеваний: дистрофии мышц (болезнь Дюшенна), болезни Паркинсона, при которых ПОЛ разрушает нервные клетки в стволовой части мозга, при атеросклерозе, развитии опухолей. Перекисное окисление активируется также в тканях, подвергшихся сначала ишемии, а затем реоксигенации, что происходит, например, при спазме коронарных артерий и последующем их расширении.
Такая же ситуация возникает при образовании тромба в сосуде, питающем миокард. Формирование тромба приводит к окклюзии просвета сосуда и развитию ишемии в соответствующем участке миокарда (гипоксия ткани). Если принять быстрые лечебные меры по разрушению тромба, то в ткани восстанавливается снабжение кислородом (реоксигенация). Показано, что в момент реоксигенации резко возрастает образование активных форм кислорода, которые могут повреждать клетку. Таким образом, даже несмотря на быстрое восстановление кровообращения, в соответствующем участке миокарда происходит повреждение клеток за счёт активации перекисного окисления.
Изменение структуры тканей в результате ПОЛ можно наблюдать на коже: с возрастом увеличивается количество пигментных пятен на коже, особенно на дорсальной поверхности ладоней. Этот пигмент называют липофусцин, представляющий собой смесь липидов и белков, связанных между собой поперечными ко-валентными связями и денатурированными в результате взаимодействия с химически активными группами продуктов ПОЛ. Этот пигмент фагоцитируется, но не гидролизуется ферментами лизосом, и поэтому накапливается в клетках, нарушая их функции.
ПОЛ происходит не только в живых организмах, но и в продуктах питания, особенно при
430
неправильном приготовлении и хранении пищи. Прогоркание жиров, образование более тёмного слоя на поверхности сливочного масла, появление специфического запаха у молочных продуктов - всё это признаки ПОЛ. В продукты питания, содержащие ненасыщенные липи-ды, обычно добавляют антиоксиданты - вещества, ингибирующие ПОЛ и сохраняющие структуру компонентов пищи.
Г. Системы защиты клеток от активных форм кислорода
Ферменты антиоксидантного действия
К ферментам, защищающим клетки от действия активных форм кислорода, относят супе-роксиддисмутазу, каталазу и глутатионпероксидазу; Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450 и пероксисом особенно велико. Супероксиддисмутаза (СОД) превращает супероксидные анионы в пероксид водорода:
2 + 2H+ → H2O2 + O2
+ 2H+ → H2O2 + O2
Изоферменты СОД находятся и в цитозоле и в митохондриях и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода при утечке электронов из дыхательной цепи.
СОД - индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется перекисное окисление.
Пероксид водорода, который может инициировать образование самой активной формы ОН•, разрушается ферментом каталазой:
2Н2О2 → 2 Н2О + О2.
Каталаза находится в основном в пероксисомах, где образуется наибольшее количество пероксида водорода, а также в лейкоцитах, где она защищает клетки от последствий "респираторного взрыва" (см. раздел 6).
Глутатионпероксидаза - важнейший фермент, обеспечивающий инактивацию активных форм кислорода, так как он разрушает и пероксид водорода и гидропероксиды липидов. Он катализирует восстановление пероксидов с помощью трипептида глутатиона (γ-глутамилцистеинилглицин). Сульфгидрильная группа глутатиона (GSH) служит донором электронов и, окисляясь, образует дисульфидную форму глутатиона, в которой 2 молекулы глутатиона связаны через дисульфидную группу.
Н2О2 + 2 GSH → 2 Н2О + G-S-S-G.
Окисленный глутатион восстанавливается глутатионредуктазой:
GS-SG + NADPH + Н+ → 2 GSH + NADP+.
Глутатионпероксидаза, которая восстанавливает гидропероксиды липидов в составе мембран, в качестве кофермента использует селен (необходимый микроэлемент пищи). При его недостатке активность антиоксидантной защиты снижается.
Витамины, обладающие антиоксидантным действием
Витамин Е (α-токоферол) - наиболее распространённый антиоксидант в природе - является липофильной молекулой, способной инактивировать свободные радикалы непосредственно в гидрофобном слое мембран и таким образом предотвращать развитие цепи перекисного окисления. Различают 8 типов токоферолов, но α-токоферол наиболее активен.
Витамин Е отдаёт атом водорода свободному радикалу пероксида липида (ROO•), восстанавливая его до гидропероксида (ROOH) и таким образом останавливает развитие ПОЛ (рис. 8-56).
Свободный радикал витамина Е, образовавшийся в результате реакции, стабилен и не способен участвовать в развитии цепи. Наоборот, радикал витамина Е непосредственно взаимодействует с радикалами липидных перекисей, восстанавливая их, а сам превращается в стабильную окисленную форму -- токоферолхинон.
Витамин С (аскорбиновая кислота) также является антиоксидантом и участвует с помощью двух различных механизмов в ингибировании ПОЛ. Во-первых, витамин С восстанавливает окисленную форму витамина Е и таким образом поддерживает необходимую концентрацию этого антиоксиданта непосредственно в мембранах клеток. Во-вторых, витамин С, будучи водорастворимым витамином и сильным восстановителем, взаимодействует с водорастворимыми активными формами кислорода -  , Н2О2, ОН• и инактивирует их.
, Н2О2, ОН• и инактивирует их.
58. Непрямое дезаминирование аминокислот. Роль глутаматдегидрогеназы и глутаминовой кислоты. Реакции трансаминирования, ферменты, биологическое значение.
Дезаминирование аминокислот – отщепление аминогруппы от аминокислоты с образованием аммиака (NН3). В тканях человека преобладает окислительное дезаминирование, то есть сопряжённое с переносом водорода.
23.5.2. Большинство ферментов, участвующих в окислительном дезаминировании аминокислот, при физиологических значениях рН малоактивны. Поэтому основная роль в окислительном дезаминировании принадлежит глутаматдегидрогеназе, которая катализирует прямое окислительное дезаминирование глутамата. В качестве кофермента используются НАД+ или НАДФ+(производные витамина РР). Реакция обратима.
Глутаматдегидрогеназа – аллостерический фермент, его аллостерическими активаторами являются АДФ и ГДФ, аллостерическими ингибиторами – АТФ, ГТФ и НАДН.
23.5.3. Непрямое дезаминирование характерно для большинства аминокислот. Оно называется непрямым, потому что происходит в 2 этапа:
- на первом этапе аминокислота подвергается трансаминированию с образованием глутамата;
- на втором этапе происходит окислительное дезаминирование глутамата (см. рисунок 21.3).
Рисунок 23.3. Схема непрямого дезаминирования аминокислот.
Участие аминотрансфераз в этом процессе позволяет собрать аминогруппы различных аминокислот в составе одной аминокислоты – глутамата, который затем подвергается окислению с образованием аммиака и α-кетоглутарата.
59. Декарбоксилирование аминокислот. Образование биогенных аминов — гистамина, серотонина, ГАМК. Роль биогенных аминов в регуляции метаболизма и функций. Распад биогенных аминов.
Декарбоксилирование аминокислот – отщепление карбоксильной группы от аминокислоты с образованием СО2. Продуктами реакций декарбоксилирования аминокислот являютсябиогенные амины, участвующие в регуляции обмена веществ и физиологических процессов в организме (см. таблицу 23.1).
Таблица 23.1
Биогенные амины и их предшественники.
| Аминокислота | Биогенный амин |
|---|---|
| Гистидин | Гистамин |
| Глутамат | γ-аминомасляная кислота (ГАМК) |
| Тирозин | Дофамин |
| Триптофан | Триптамин |
| Серотонин | |
| Цистеин | Тиоэтиламин |
| Таурин |
Реакции декарбоксилирования аминокислот и их производных катализируют декарбоксилазы аминокислот. Кофермент – пиридоксальфосфат (производное витамина В6). Реакции являются необратимыми.
23.6.2. Примеры реакций декарбоксилирования. Некоторые аминокислоты непосредственно подвергаются декарбоксилированию. Реакция декарбоксилирования гистидина:

Гистамин обладает мощным сосудорасширяющим действием, особенно капилляров в очаге воспаления; стимулирует желудочную секрецию как пепсина, так и соляной кислоты, и используется для исследования секреторной функции желудка.
Реакция декарбоксилирования глутамата:
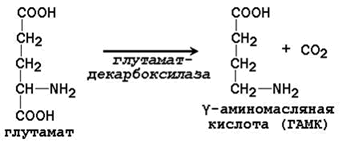
ГАМК – тормозный медиатор в центральной нервной системе.
Ряд аминокислот подвергается декарбоксилированию после предварительного окисления. Продукт гидроксилирования триптофана превращается в серотонин:

Серотонин образуется главным образом в клетках центральной нервной системы, обладает сосудосуживающим действием. Участвует в регуляции артериального давления, температуры тела, дыхания, почечной фильтрации.
Продукт гидроксилирования тирозина переходит в дофамин:

Дофамин служит предшественником катехоламинов; является медиатором ингибирующего типа в центральной нервной системе.
Тиогруппа цистеина окисляется до сульфогруппы, продукть этой реакции декарбоксилируется с образованием таурина:

Таурин образуется главным образом в печени; участвует в синтезе парных желчных кислот (таурохолевой кислоты).
21.5.3. Катаболизм биогенных аминов. В органах и тканях существуют специальные механизмы, предупреждающие накопление биогенных аминов. Основной путь инактивации биогенных аминов – окислительное дезаминирование с образованием аммиака – катализируется моно- и диаминооксидазами.
Моноаминооксидаза (МАО) - ФАД-содержащий фермент – осуществляет реакцию:

В клинике используются ингибиторы МАО (ниаламид, пиразидол) для лечения депрессивных состояний.
60. Источники образования аммиака и пути его обезвреживания в организме. Связывание аммиака в местах образования и транспорт в печень. Особенности детоксикации аммиака у детей первого года жизни.
Аммиак (NН3) – продукт обмена большинства соединений, содержащих амино- и амидогруппы. Главным путём образования аммиака служит окислительное дезаминирование.
Аммиак – очень токсичное вещество, особенно для нервной системы. При физиологических значениях рН молекула NН3 легко превращается в ион аммония NН4+, который не способен проникать через биологические мембраны и задерживается в клетке. Накопление NН4+ вызывает торможение заключительных этапов цикла трикарбоновых кислот и снижение продукции АТФ. Поэтому в организме существует ряд механизмов связывания (обезвреживания) аммиака (см. рисунок 24.1).
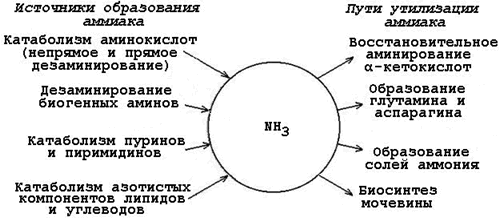
Рисунок 24.1. Образование аммиака в организме и его обезвреживание.
ОБНОВЛЕНИЯ
ПОДПИСАТЬСЯ НА РАССЫЛКУ
ПРЕДМЕТЫ
- Анатомия
- Акушерство и гинекология
- БЖД, медицина катастроф
- Биохимия
- Биология
- Гистология
- Гигиена
- Генетика
- Диетология
- Дерматовенерология
- Инфекционные болезни
- Культурология
- Лабораторная диагностика
- Летняя практика
- Лучевая диагностика
- Медицинская информатика
- Микробиология
- Неврология
- Общественное здоровье
- Общий уход
О НАС
«Dendrit» - информационный портал для медицинских работников, студентов медицинских ВУЗов, исследователей и пациентов.
Ваш источник новостей и знаний о здоровье.