ПОДПИСАТЬСЯ НА РАССЫЛКУ
Общие пути катаболизма и биосинтеза аминокислот
Тема: «ОБЩИЕ ПУТИ ОБМЕНА АМИНОКИСЛОТ. ТРАНСАМИНИРОВАНИЕ, ДЕЗАМИНИРОВАНИЕ И ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ»
1. Азотистый баланс организма как важнейшая характеристика белкового обмена. Примеры состояний, сопровождающихся положительным и отрицательным азотистым балансом.
2. Источники аминокислот в тканях и пути их использования.
3. Общие пути катаболизма аминокислот в тканях. Трансаминирование аминокислот: ферменты, кофермент, примеры реакций, роль в организме.
4. Прямое и непрямое дезаминирование аминокислот в тканях: ферменты, коферменты, реакции, роль в организме.
5. Декарбоксилирование аминокислот: ферменты, кофермент, примеры реакций. Биогенные амины (серотонин, гистамин, ГАМК, этаноламин и др.), роль в организме, пути инактивации.
6. Клинико-диагностическое значение определения активности аланин- и аспартатаминотрансфераз в крови.
| Раздел 23.1 |
Аминокислотный фонд организма |
|
|
|
|
23.1.1. В организме человека содержится около 100 г свободных аминокислот, которые образуют его аминокислотный фонд. Этот фонд постоянно пополняется за счёт поступления новых молекул аминокислот взамен тех, которые были использованы в метаболических процессах. Источники и пути использования свободных аминокислот в организме представлены на рисунке 23.1.
Рисунок 23.1. Образование и использование свободных аминокислот в организме. 23.1.2. Исследования с помощью радиоактивных меток показывают, что у здорового взрослого человека общая скорость синтеза белка в организме составляет около 400 – 500 г в сутки, причём на 3/4 этот синтез обеспечивается за счёт эндогенных ресурсов. Этим объясняется тот факт, что даже при голодании синтез определённых белков происходит с достаточно высокой скоростью. |
|
| Раздел 23.2 |
Азотистый баланс. |
|
|
|
|
23.2.1. Для правильной оценки соотношения процессов биосинтеза и расщепления белков в организме достаточно точным параметром является азотистый баланс. Азотистый баланс – разница между количеством азота, поступившим в организм с пищей, и количеством азота, выведенного из организма с мочой, калом, слюной и потом. 23.2.2. Если количество поступившего азота превышает количество выделившегося азота, то наблюдается положительный азотистый баланс. Он характерен для всех состояний, при которых скорость синтеза белка в организме выше, чем скорость его распада, например:
23.2.3. Если количество азота, выведенного из организма, превышает количество азота, поступившее с пищей, то наблюдается отрицательный азотистый баланс. Он встречается во всех случаях, когда распад белков в организме преобладает над их синтезом, например:
23.2.4. В состоянии азотистого равновесия организм теряет в сутки столько же азота, сколько получает с пищей. Это характерно для взрослых здоровых людей при нормальном питании. |
|
| Раздел 23.3 |
Белки пищи - главный источник аминокислот для организма |
|
|
|
|
23.3.1. Пищевые белки, поступающие в организм, используются как источник аминокислот для синтеза собственных структурных, каталитических, транспортных, рецепторных и других белков, а также веществ небелковой природы. 23.3.2. Суточная потребность в белках для взрослого человека зависит от возраста, профессии, состояния здоровья, условий труда, климатических и иных факторов. Установлено, что взрослый человек при средних энергетических затратах должен получать 100 – 120 г белка в сутки. 23.3.3. Необходимо также учитывать биологическую ценность белков. Чем ближе аминокислотный состав пищевого белка к аминокислотному составу белков тела, тем лучше он усваивается и тем выше его биологическая ценность. Это тем более важно, что 8 аминокислот в организме взрослого человека синтезироваться не могут. Такие аминокислоты называются незаменимыми, к ним относятся: валин, лейцин, изолейцин, лизин, метионин, треонин, фенилаланин и триптофан. Остальные 12 аминокислот являются заменимыми, они способны синтезироваться в организме человека и недостаток их в пище может быть возмещён за счет других аминокислот. |
|
| Раздел 23.4 |
Трансаминирование аминокислот |
|
|
|
|
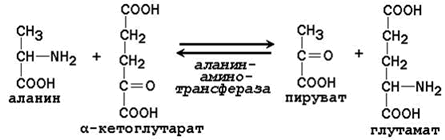
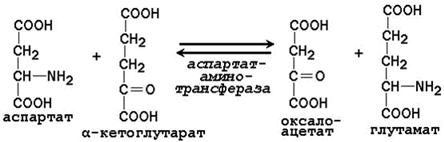
23.4.1. К общим путям метаболизма аминокислот относятся реакции трансаминирования, дезаминирования и декарбоксилирования. 23.4.2. Трансаминирование аминокислот – перенос аминогруппы (NН2-) от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Реакции трансаминирования катализируют ферменты – аминотрансферазы (или трансаминазы). Кофермент аминотрансфераз – пиридоксальфосфат (производное витамина В6). В реакции принимает участие альдегидная группа кофермента. Реакция легко обратима. Механизм реакции трансаминирования представлен на рисунке 23.2.
Рисунок 23.2. Механизм переноса аминогруппы с аминокислоты на α-кетокислоту в реакции трансаминирования. Примеры реакций трансаминирования:
23.4.3. Роль реакций трансаминирования в организме:
|
|
| Раздел 23.5 |
Дезаминирование аминокислот. |
|
|
|
|
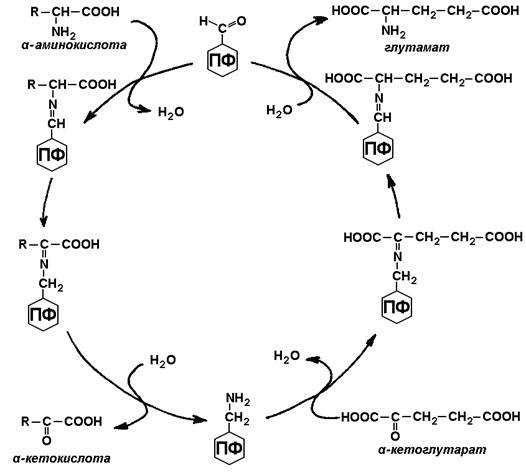
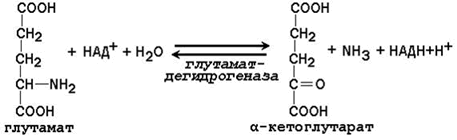
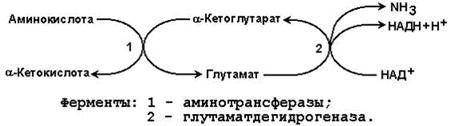
23.5.1. Дезаминирование аминокислот – отщепление аминогруппы от аминокислоты с образованием аммиака (NН3). В тканях человека преобладает окислительное дезаминирование, то есть сопряжённое с переносом водорода. 23.5.2. Большинство ферментов, участвующих в окислительном дезаминировании аминокислот, при физиологических значениях рН малоактивны. Поэтому основная роль в окислительном дезаминировании принадлежит глутаматдегидрогеназе, которая катализирует прямое окислительное дезаминирование глутамата. В качестве кофермента используются НАД+ или НАДФ+(производные витамина РР). Реакция обратима.
Глутаматдегидрогеназа – аллостерический фермент, его аллостерическими активаторами являются АДФ и ГДФ, аллостерическими ингибиторами – АТФ, ГТФ и НАДН. 23.5.3. Непрямое дезаминирование характерно для большинства аминокислот. Оно называется непрямым, потому что происходит в 2 этапа:
Рисунок 23.3. Схема непрямого дезаминирования аминокислот. Участие аминотрансфераз в этом процессе позволяет собрать аминогруппы различных аминокислот в составе одной аминокислоты – глутамата, который затем подвергается окислению с образованием аммиака и α-кетоглутарата. |
|
| Раздел 23.6 |
Декарбоксилирование аминокислот. |
||||||||||||||
|
|
|||||||||||||||
|
23.6.1. Декарбоксилирование аминокислот – отщепление карбоксильной группы от аминокислоты с образованием СО2. Продуктами реакций декарбоксилирования аминокислот являютсябиогенные амины, участвующие в регуляции обмена веществ и физиологических процессов в организме (см. таблицу 23.1). Таблица 23.1 Биогенные амины и их предшественники.
Реакции декарбоксилирования аминокислот и их производных катализируют декарбоксилазы аминокислот. Кофермент – пиридоксальфосфат (производное витамина В6). Реакции являются необратимыми. 23.6.2. Примеры реакций декарбоксилирования. Некоторые аминокислоты непосредственно подвергаются декарбоксилированию. Реакция декарбоксилирования гистидина:
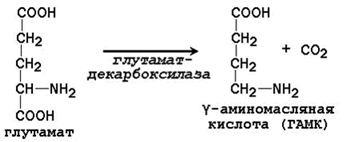
Гистамин обладает мощным сосудорасширяющим действием, особенно капилляров в очаге воспаления; стимулирует желудочную секрецию как пепсина, так и соляной кислоты, и используется для исследования секреторной функции желудка. Реакция декарбоксилирования глутамата:
ГАМК – тормозный медиатор в центральной нервной системе. Ряд аминокислот подвергается декарбоксилированию после предварительного окисления. Продукт гидроксилирования триптофана превращается в серотонин:
Серотонин образуется главным образом в клетках центральной нервной системы, обладает сосудосуживающим действием. Участвует в регуляции артериального давления, температуры тела, дыхания, почечной фильтрации. Продукт гидроксилирования тирозина переходит в дофамин:
Дофамин служит предшественником катехоламинов; является медиатором ингибирующего типа в центральной нервной системе. Тиогруппа цистеина окисляется до сульфогруппы, продукть этой реакции декарбоксилируется с образованием таурина:
Таурин образуется главным образом в печени; участвует в синтезе парных желчных кислот (таурохолевой кислоты). 21.5.3. Катаболизм биогенных аминов. В органах и тканях существуют специальные механизмы, предупреждающие накопление биогенных аминов. Основной путь инактивации биогенных аминов – окислительное дезаминирование с образованием аммиака – катализируется моно- и диаминооксидазами. Моноаминооксидаза (МАО) - ФАД-содержащий фермент – осуществляет реакцию:
В клинике используются ингибиторы МАО (ниаламид, пиразидол) для лечения депрессивных состояний. |
|||||||||||||||
| Раздел 23.7 | Биосинтез аминокислот в тканях. |
|
|
|
|
23.7.1. В организме человека возможен синтез заменимых аминокислот, к которым относятся: аланин, аргинин, аспартат, гистидин, глицин, глутамат, глутамин, пролин, серин, тирозин, цистеин. Недостаток в пище любой из этих аминокислот не будет сопровождаться её дефицитом в организме. Основными путями образования заменимых аминокислот являются: 1)трансаминирование α-кетокислот, 2) восстановительное аминирование α-кетокислот, 3) синтез с участием незаменимых аминокислот.
23.7.2. Трансаминирование (см. тему 23.4). Источниками атомов углерода в этих реакциях служат метаболиты гликолиза и цикла Кребса, источниками атомов азота – другие аминокислоты, чаще всего – глутамат (см. рисунок 23.4).
23.7.3. Восстановительное аминирование (см. тему 24). Источником атома азота аминогруппы является молекула аммиака, источником углерода - α-кетокислоты, чаще всего - α-кетоглутарат (см. рисунок 23.4).
 Рисунок 23.4. Биосинтез заменимых аминокислот в тканях с использованием углеродного скелета глюкозы (одной звёздочкой показаны реакции трансаминирования, двумя – восстановительного аминирования).
23.7.4. Синтез с участием незаменимых аминокислот. Заменимая аминокислота тирозин может образоваться из незаменимой аминокислоты фенилаланина:
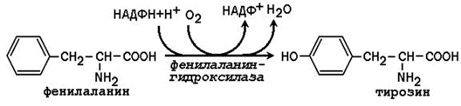 Фенилаланингидроксилаза - типичная цитохром P450-зависимая гидроксилаза со смешанной функцией: один атом кислорода включается в воду и другой в гидроксильную группу тирозина. Восстановителем служит кофактор тетрагидробиоптерин, который поддерживается в восстановленном состоянии НАДФН-зависимым ферментом дигидробиоптерин-редуктазой.
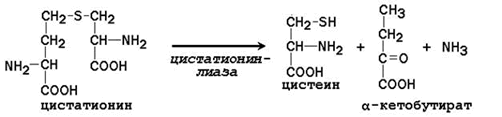
Заменимая аминокислота цистеин синтезируется при участии незаменимой аминокислоты метионина, которая используется как источник атома серы. После отдачи метильной группы в реакциях трансметилирования метионин превращается в гомоцистеин. При его взаимодействии с заменимой аминокислотой серин образуется цистатионин:
 Цистатионин подвергается расщеплению с образованием цистеина и гомосерина, который подвергается дезаминированию в α-кетобутират:
 Таким образом, фенилаланин и метионин, поступающие с пищей, частично используются для синтеза заменимых аминокислот. Поэтому суточная потребность в фенилаланине и метионине может быть существенно снижена при поступлении в организм дополнительных количеств тирозина и цистеина соответственно.
|
|
ОБНОВЛЕНИЯ
ПОДПИСАТЬСЯ НА РАССЫЛКУ
ПРЕДМЕТЫ
- Анатомия
- Акушерство и гинекология
- БЖД, медицина катастроф
- Биохимия
- Биология
- Гистология
- Гигиена
- Генетика
- Диетология
- Дерматовенерология
- Инфекционные болезни
- Культурология
- Лабораторная диагностика
- Летняя практика
- Лучевая диагностика
- Медицинская информатика
- Микробиология
- Неврология
- Общественное здоровье
- Общий уход
О НАС
«Dendrit» - информационный портал для медицинских работников, студентов медицинских ВУЗов, исследователей и пациентов.
Ваш источник новостей и знаний о здоровье.