ПОДПИСАТЬСЯ НА РАССЫЛКУ
Болезни почек
ЛЕКЦИЯ №4. БОЛЕЗНИ ПОЧЕК.
Болезни почек принято делить на две большие группы:
- нефропатии;
- другие заболевания почек.
Нефропатии представляют собой заболевания, в основе которых лежит двустороннее диффузное поражением почек. Исходя из структурно-функционального принципа, их разделяют на:
- гломерулопатии;
- тубулопатии.
ГЛОМЕРУЛЯРНЫЕ ЗАБОЛЕВАНИЯ ПОЧЕК или ГЛОМЕРУЛОПАТИИ
Это группа заболеваний характеризуется первичным поражением клубочкового аппарата почек, как структурным (воспаление, клеточная пролиферация, утолщение базальной мембраны, фиброз, нарушение структуры эпителиальных клеток), так и функциональным (повышенная проницаемость является причиной протеинурии и гематурии клубочкового происхождения).
Номенклатура повреждений клубочков
фокальным (очаговым), при этом поражается часть клубочков, а другие клубочки остаются нормальными;
диффузным, когда поражаются все клубочки;
глобальным, когда поражается весь клубочек;
сегментарным, когда поражается только часть клубочка.
Патогенез гломерулонефритов
Повреждения клубочков могут иметь иммунные или неиммунные механизмы.
Иммунное повреждение клубочков
Иммунное повреждение наблюдается при большинстве гломерулярных заболеваний почек. Имеется два механизма такого повреждения:
- действие нефротоксических антител, в основном против базальной мембраны клубочков (антитела против базальной мембраны (анти-БМК антитела), антитела против не-БМК антигенов);
- отложение иммунных комплексов.
Нефротоксические антитела
В настоящее время установлено, что в реакции антител против антигенов на клубочковой фильтрационной мембране принимают участие два типа нефротоксических антител:
Накопление антител против антигенов базальной мембраны клубочка (БМК), реагирующих с эпитопами на молекулах коллагена IV типа, приводит к фиксации и активации комплемента (рис. 1), при этом при иммунофлюоресценции определяется линейное накопление иммуноглобулинов и комплемента в базальной мембране. Линейное накопление антител связано с тем, что антигенные эпитопы являются частью повторяющихся субъединиц, которые равномерно расположены на базальной мембране. В тех случаях, когда организм начинает вырабатывать IgG против антигенных гликопротеинов базальной мембраны клубочков, возникает противомембранная болезнь. Эти изменение приводят к развитию ярко выраженного пролиферативного гломерулонефрита с кровоизлияниями.
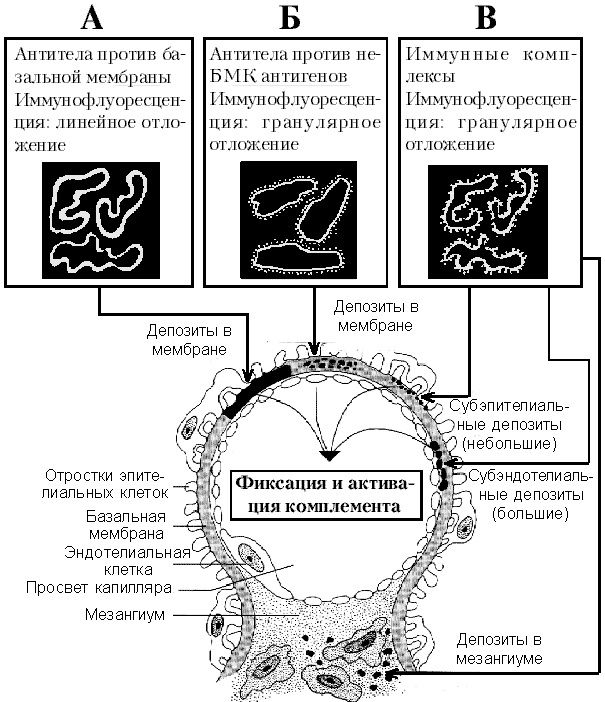
Рис. 1. Основные типы повреждения клубочка
А: Повреждение анти-БМК антителами, при этом наблюдается линейный тип отложения антител при иммунофлуоресценции.
Б: Повреждение не-БМК антителами, при этом наблюдается гранулярный тип отложения антител.
В: Повреждение в результате отложения иммунных комплексов, при этом также обнаруживается гранулярный тип отложения.
Во всех случаях происходит активация комплемента комплексами антиген-антитело с развитием повреждения клубочка.
Противомембранная болезнь наблюдается, в основном, у молодых мужчин. Обычно она проявляется быстро нарастающей почечной недостаточностью. Иногда у больных может быть гематурия и протеинурия или нефротический синдром. Гистологически характерной картиной является фокальный и сегментарный пролиферативный гломерулонефрит. При более тяжелых случаях наблюдается сегментарный некроз с отложением фибрина и быстро прогрессирующий “полулунный” гломерулонефрит. Противомембранная болезнь наблюдается при синдроме Гудпасчера.
Фильтрационная мембрана клубочка содержит также и другие антигены, против которых могут реагировать антитела. Эти не-БМК антигены расположены в базальной мембране равномерно, но не всплошную, а на некотором расстоянии друг от друга, поэтому при иммунофлюоресценции накопление будет не линейное, а гранулярное, напоминая картину при отложении иммунных комплексов (рис. 1).
Отложение иммунных комплексов
Почки являются одним из путей, через который в норме выводятся иммунные комплексы из организма. Положительно заряженные молекулы легко проникают в субэпителиальное пространство благодаря полианионной природе базальной мембраны. Большие иммунные комплексы, которые формируются при наличии антител с высокой аффинностью к антигену, оседают преимущественно в мезангиуме. Если антитела имеют среднюю или низкую аффинность, то образуются небольшие иммунные комплексы, которые оседают в периферических петлях субэпителиально.
Циркулирующие иммунные комплексы (ЦИК) откладываются на клубочковой фильтрационной мембране или в мезангиуме (рис. 1); в результате чего происходит фиксация комплемента и развитие воспаления.
После отложения иммунных комплексов в базальной мембране происходит активация системы комплемента и высвобождение вазоактивных веществ. Эти вещества являются медиаторами острого воспаления и они ответственны за повреждение базальной мембраны. Этими веществами являются:
- Комплемент.
- Нефритические факторы (NeF-AP и NeF-CP).
- Полиморфноядерные лейкоциты.
- Факторы свертывания крови.
В каждом конкретном случае могут участвовать не все приведенные факторы. От сочетания различных медиаторов зависит гистологический тип повреждения при гломерулонефритах.
Классификация гломерулопатий
Невозможно составить полностью удовлетворяющую всем требованиям классификацию гломерулярных заболеваний на основе какого-либо одного признака. Поэтому существует три параллельные и дополняющие друг друга классификации: этиологическая, иммунологическая и морфологическая.
Гломерулопатии могут быть врожденными и приобретенными. Врожденные гломерулярные заболевания (наиболее часто встречается синдром Альпорта, при котором нефрит сочетается с дегенерацией слухового нерва и катарактой) наблюдаются очень редко. В данной лекции будут рассмотрены приобретенные гломерулярные заболевания.
Причиной развития гломерулонефритов могут быть инфекционные и неинфекционные факторы (антигены), наследственная предрасположенность, лекарственные воздействия, избыточная инсоляция и др.
Таблица 1
Классификация гломерулопатий
|
Врожденные гломерулонефриты |
1 «Первичные» означает то, что поражение почек является главным проявлением заболевания.
2 «Вторичный» означает то, что поражение почек является частью системного заболевания, например, при системной красной волчанке и прогрессирующем системном склерозе.
ПЕРВИЧНЫЕ ГЛОМЕРУЛЯРНЫЕ ЗАБОЛЕВАНИЯ
Гломерулярная болезнь с минимальными изменениями (идиопатический нефротический синдром) наиболее часто развивается у детей в возрасте до 8 лет (80%) и редко у взрослых и сопровождается нефротическим синдромом. Пик заболеваемости лежит между 2 и 4 годами. Чаще болеют мальчики. Это заболевание также известно под названием липоидный нефрит, т.к. при нем часто в клетках канальцев обнаруживаются жиры, что является наиболее значимым микроскопическим признаком.
Этиология и патогенез. Основным изменением при данной патологии является снижение в базальной мембране содержания полианионов (в основном гепаран сульфата (протеогликан)), что приводит к снижению отрицательного заряда в мембране. В результате ослабевает фильтрационный барьер для анионных молекул плазмы, например, альбуминов, которые начинают проникать сквозь мембрану в больших количествах. При этом из всех белков плазмы теряются в основном альбумины, поэтому для гломерулярной болезни с минимальными изменениями характерна “селективная” протеинурия. Слияние отростков эпителиальных клеток является неспецифическим ответом на повышенную фильтрацию белков.
Причина химических изменений в мембране неизвестна. У некоторых больных заболевание развивается после респираторных инфекций и профилактических прививок. Иммунологическая основа болезни подтверждается следующими признаками: 1) связью заболевания с инфекциями, иммунизацией и атопическими реакциями, такими как сенная лихорадка и экзема; 2) отличной эффективностью терапии иммуносупрессивными лекарствами, например, кортикостероидами.
Патологическая анатомия. При световой микроскопии никаких изменений не обнаруживается (отсюда термин “минимальные изменения”). При иммунофлюоресценции также не выявляется отложение иммуноглобулинов и комплемента. При электронной микроскопии обнаруживается слияние отростков подоцитов (“болезнь эпителиальных клеток”) (рис. 2). Эти изменения исчезают во время ремиссии.
Повреждения, вызванные иммунными комплексами, приводит к развитию различных реакций в клубочках, которые зависят от природы иммунных комплексов. Это повреждение может проявляться в виде диффузного либо фокального пролиферативного гломерулонефрита.
Гломерулонефриты в настоящее время делят на:
ü постинфекционный (острый диффузный пролиферативный);
ü быстропрогрессирующий, злокачественный (подострый);
ü хронический.
Рис. 2. Гломерулонефрит с минимальными изменениями.
Заболевания, связанные с накоплением иммунных комплексов
Постинфекционный (острый диффузный пролиферативный) гломерулонефрит является одним из типов повреждения клубочков, имеющий постинфекционную этиологию. Причиной данного заболевания могут быть не только стрептококки. Существуют сообщения об этиологической роли таких микроорганизмов, как Staphylococcus aureus, Streptococcus pneumoniae, Neisseria meningitidis, плазмодия малярии, Toxoplasma gondii и некоторых вирусов. Иммунные комплексы, формирующиеся между антигенами и антителами в организме хозяина, откладываются на фильтрационной мембране клубочка, происходит фиксация комплемента и развитие воспаления. До сих пор не обнаружен специфический стрептококковый антиген, который участвует в образовании иммунных комплексов.
Только из-за значительного превалирования над другими типами постстрептококковый гломерулонефрит рассматривается в данной лекции самостоятельно.
Острый постстрептококковый гломерулонефрит является одним из самых распространенных заболеваний у детей. У взрослых он встречается намного реже.
Наиболее частой причиной является β-гемолитический стрептококк группы А. Не все стрептококковые инфекции представляют опасность в плане развития гломерулонефрита. Существуют так называемые “нефритогенные” штаммы стрептококков М типа, особенно серотипов 1, 4, 12 и 49.
Первичная инфекция обычно проявляется в виде ангины, фарингита, реже отита и воспалительных поражений кожи.
Патологическая анатомия. Макроскопически почки слегка увеличены из-за отека. Капсула снимается легко, обнажая гладкую ровную поверхность. В тяжелых случаях на поверхности могут быть многочисленные петехии (красный крап).
При микроскопическом исследовании определяется диффузный гломерулонефрит. В начальной стадии клубочки увеличены, в них увеличено количество клеток (рис. 3). Увеличение количества клеток возникает в результате пролиферации мезангиальных, эндотелиальных и эпителиальных клеток наружного листка капсулы клубочка, а также различной степени выраженности инфильтрации полиморфноядерными лейкоцитами. Выраженный отек и набухание эндотелия приводит к сужению просвета капилляров.
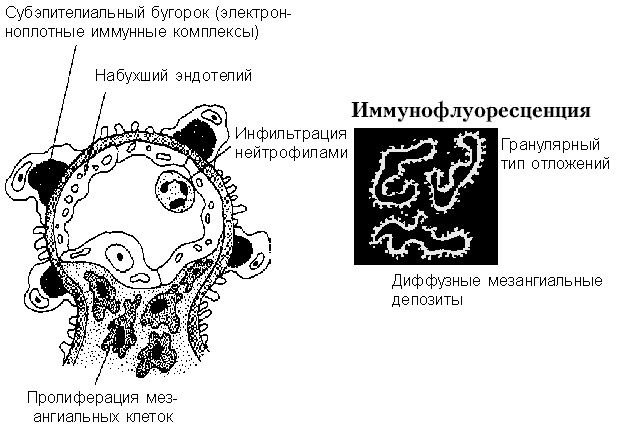
Рис. 3. Постстрептококковый гломерулонефрит.
Постстрептококковый гломерулонефрит характеризуется отложением электронноплотных иммунных комплексов под эпителием и в мезангиуме. Активация комплемента приводит к пролиферации клеток и воспалению.
При световой микроскопии могут обнаруживаться иммунные комплексы в виде характерных “глыбок”, особенно при трихромных окрасках. При электронной микроскопии они представляют собой большие электронно-плотные отложения в виде купола на эпителиальной стороне базальной мембраны (субэпителиальные «горбы») (рис. 3). Также часто определяются отложения иммунных комплексов в мезангиуме, в субэндотелиальных и внутримембранных регионах. При иммунофлюоресценции определяются гранулярные отложения IgG и С3 вдоль базальной мембраны клубочка и в мезангиуме.
Прогноз. Благодаря применению противовоспалительной и иммуносупрессивной терапии 95% пациентов клинически выздоравливают в течение 6 недель. Нормальная функция почек восстанавливается в течение года. Иногда может сохраняться увеличение числа клеток в мезангиуме в течение многих месяцев, и даже лет. Нарушения в осадке мочи могут существовать в течение нескольких лет. У небольшого числа больных отмечается прогрессия с быстрым развитием почечной недостаточности в течение 1-2 лет. У этих больных обнаруживается наличие множественных полулуний (подострый гломерулонефрит – см. ниже).
Быстропрогрессирующий (подострый) гломерулонефрит – это редкое заболевание, которое отражает тяжелое поражение клубочков. Подострый гломерулонефрит характеризуется:
- наличием более чем в 70% клубочков эпителиальных полулуний. Полулуния, заполняющие капсулу Боумена, состоят из эпителиальных клеток и макрофагов, пролиферирующих в ответ на выпот фибрина из поврежденных клубочков. Полулуния представляют собой необратимое повреждение клубочка, приводящее к его склерозированию. В полулуниях обязательно находят фибрин, который, как предполагается, и является причиной их образования.
- быстрой прогрессией, приводящей к почечной недостаточности в течение нескольких месяцев. Быстро развивается нефросклероз и гипертензия.
Быстропрогрессирующий гломерулонефрит обычно является конечной стадией многих заболеваний почек, которые приводят к тяжелому повреждению клубочкового аппарата почек (табл. 2). Наиболее часто он развивается после стрептококкового гломерулонефрита и при синдроме Гудпасчера. По патогенезу он одновременно является и иммунокомплексным, и антительным.
Патологическая анатомия. Макроскопически почки резко увеличены (массой до 300-500 г, при норме 120-150 г), дряблые, корковый слой утолщен, набухший, бледный, белого цвета (“большая белая почка”), либо желто-серый, тусклый, с красным крапом и хорошо отграничен от темно-красного мозгового вещества почки (“большая пестрая почка”), либо красный и сливается с полнокровными пирамидами (“большая красная почка”).
Для постановки диагноза необходимо наличие не менее 70% клубочков с полулуниями, т.к. полулуния в небольшом количестве могут обнаруживаться при различных гломерулопатиях. Выражен тубуло-интерстициальный компонент (дистрофические изменения эпителия канальцев, воспалительные инфильтраты в строме).
Таблица 2
Причины развития быстропрогрессирующего гломерулонефрита
|
Постинфекционный |
Синдром Гудпасчера встречается редко. Наиболее часто он развивается у подростков, у мужчин несколько чаще, чем у женщин. У 80% больных определяется HLA-DR2 антиген. В сыворотке определяются анти-БМК антитела, направленные против гликопротеиновых антигенов неколлагеновой части коллагена IV типа. Эти антитела обладают способностью реагировать как с базальной мембраной клубочков почек, так и с базальной мембраной альвеол легких.
Патологическая анатомия. Первоначально при световой микроскопии обнаруживается фокальный (очаговый) пролиферативный гломерулонефрит. Затем развивается диффузный гломерулонефрит с формированием эпителиальных полулуний. На поздних стадиях определяется выраженный склероз.
При иммунофлюоресценции определяется накопление IgG и С3 с характерным линейным типом расположения вдоль базальной мембраны. Для постановки диагноза важно обнаружение С3, т.к. линейное накопление IgG вдоль мембраны может наблюдаться и при некоторых неспецифических поражениях, например, при сахарном диабете. Такой же тип накопления IgG и С3 определяется и в альвеолах легких. При электронной микроскопии обнаруживается диффузное и неравномерное утолщение базальной мембраны клубочка, однако, эти проявления являются неспецифическими. У большинства больных в легких обнаруживается обширное повреждение альвеол и внутриальвеолярные кровоизлияния с наличием в их просвете макрофагов с гранулами гемосидерина в цитоплазме.
ХРОНИЧЕСКИЙ ГЛОМЕРУЛОНЕФРИТ
Хронический гломерулонефрит – это заболевание с первичным воспалением клубочков и возможным вторичным вовлечением канальцев и стромы. У большинства больных в анамнезе есть указания на хронические почечные заболевания, однако, у 20% больных даже при первом обращении может быть обнаружена терминальная стадия хронической почечной недостаточности.
Хронические гломерулонефриты делятся на:
ü мезангиопролиферативный;
ü мембранозный;
ü мембранопролиферативный или мезангиокапиллярный.
Мезангиопролиферативный гломерулонефрит. Пролиферация мезангиальных клеток как самостоятельная патология при исследовании биопсий является неспецифической. Эта пролиферация часто носит одновременно фокальный и сегментарный характер. Патогенез во многих случаях неизвестен. При световой микроскопии определяется увеличение количества мезангиальных клеток (более трех ядер в одной дольке). При ШИК-реакции и электронной микроскопии обнаруживаются увеличение количества мезангиального матрикса и электронно-плотные отложения в нем.
Мезангиопролиферативный гломерулонефрит классифицируют на основе доминирующего иммуноглобулина, накапливающегося в клубочке. Наиболее часто в мезангиуме накапливается IgG и С3. Накопление IgA наблюдается при пурпуре Шенляйн-Геноха, системном васкулите с вовлечением почек. Известно всего лишь одно заболевание, имеющее фокальный тип поражения почек, при котором почки поражаются первично – IgA нефропатия.
IgA нефропатия (болезнь Берже) сейчас признается самой распространенной причиной хронической почечной недостаточности во всем мире. Болезнь Берже обнаруживается приблизительно у 10% больных с нефротическим синдромом. Наиболее часто она встречается у мужчин в возрасте от 10 до 30 лет. Ее признаками являются:
- поражение детей и подростков;
- эпизодическая гематурия, совпадающая по времени с респираторными инфекциями;
- легкая протеинурия, иногда нефротический синдром;
- гипертензия;
- повышение в сыворотке уровня IgA.
Этиология неизвестна, однако имеются сообщения, указывающие на географическую предрасположенность, причем наиболее часто болезнь встречается во Франции, Австралии и Сингапуре. Имеется слабая связь с HLA-DR4, но большее внимание в исследованиях направлено на обнаружение факторов, которые являются причиной повышения IgA; предположительно, ими могут быть вирусы или пищевые белки.
При световой микроскопии обнаруживается увеличение количества клеток в мезангиуме и увеличение количества мезангиального вещества. При прогрессировании заболевания развивается склероз. При иммунофлюоресцентных методах исследования обнаруживается накопление IgA в мезангиуме в виде сливающихся между собой отдельных гранул. Также часто обнаруживается С3. При электронной микроскопии определяются электронно-плотные отложения.
Прогноз. При слабой фокальной мезангиальной пролиферации с накоплением IgA и С3 в мезангиуме всех клубочков прогноз хороший. С другой стороны, при развитии мезангиокапиллярного (мембранопролиферативного) типа поражения, иногда с сегментарным некрозом, прогноз значительно ухудшается, нарушение функции почек нарастает очень быстро.
Мембранозный гломерулонефрит (МГН) имеет определенную гистологию, но множество причин. Как предполагается, морфологические изменения отражают размер и скорость формирования иммунных комплексов.
Этиология. У 85% больных не удается определить причину заболевания и, в данном случае, говорят об идиопатическом мембранозном гломерулонефрите. Наиболее частыми причинами вторичного мембранозного гломерулонефрита являются:
- инфекционные – сифилис, малярия, гепатит В, шистосомиаз, лепра;
- лекарственные – пеницилламин, золото, ртуть, героин;
- опухоли – злокачественные лимфомы, лимфома Ходжкина, бронхогенный рак легкого;
- системные заболевания соединительной ткани (системная красная волчанка, прогрессирующий системный склероз;
- другими состояниями (серповидно-клеточная анемия).
Различают три стадии заболевания (рис.4):
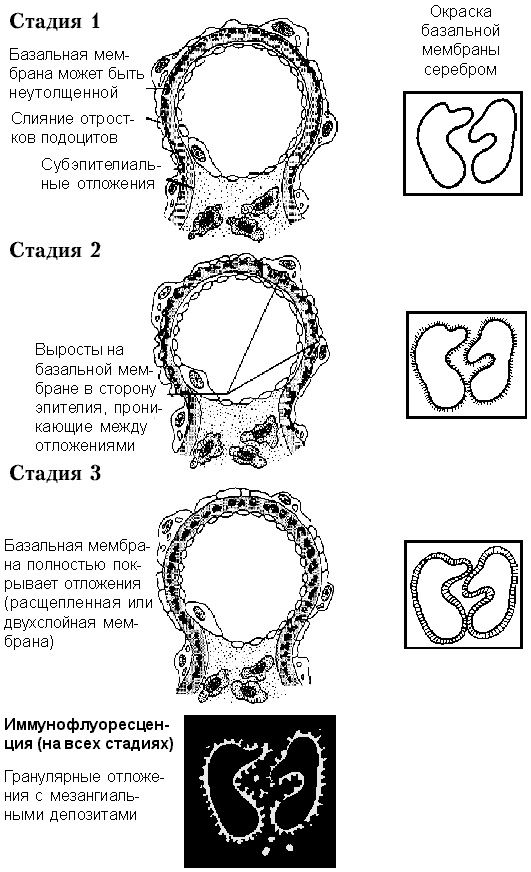
Рис. 4. Мембранозный гломерулонефрит
Во всех клубочках обнаруживается утолщение стенок капилляров без признаков пролиферации и воспаления. При иммунофлюоресценции обнаруживаются гранулярные отложения IgG и С3 в утолщенной капиллярной стенке. При электронной микроскопии определяется отложение электронно-плотных масс под эпителиальными клетками на внешней стороне базальной мембраны.
Стадия I характеризуется субэпителиальным накоплением электронно-плотных куполообразных отложений (“горбы”). На этой стадии мембрана выглядит почти нормальной, что представляет трудности для дифференциального диагноза при световой микроскопии с гломерулонефритом с минимальными изменениями. Проникновение белков сквозь фильтрационную мембрану приводит к слиянию и исчезновению отростков подоцитов, но при мембранозном гломерулонефрите обязательно обнаруживается накопление электронно-плотных иммунных комплексов.
Стадия II характеризуется появлением остроконечных выростов на базальной мембране в сторону эпителия, проникающих между отложениями, которые заметно увеличиваются. Эти выступы можно обнаружить на световой микроскопии при окраске серебром (отложения при этом не окрашиваются).
На стадии III выросты увеличиваются и сливаются с эпителиальной стороны отложений; при окраске серебром базальная мембрана выглядит расщепленной, двухслойной, слои которой соединены выростами (это создает картину цепи, где неокрашенные зоны представляют собой отложения иммунных комплексов). На этой стадии при обычной световой микроскопии обнаруживается утолщение базальной мембраны.
При чисто мембранозном гломерулонефрите в клубочке не обнаруживается пролиферация каких-либо клеток. При прогрессировании заболевания в результате утолщения мембраны клубочек превращается в гиалиновую массу. Морфологические изменения при идиопатическом и вторичном мембранозном гломерулонефрите сходны. По современным данным 70% больных живут более 10 лет. Прогноз лучше у женщин и еще лучше у детей. При вторичном МГН прогноз при излечении основного заболевания отличный. При МГН часто наблюдается повышение свертываемости крови, что может привести к тромбозу почечной вены.
Мембранопролиферативный (мезангиокапиллярный) гломерулонефрит (МПГН) характеризуется наличием двух признаков: утолщения стенки капилляров и пролиферации мезангиальных клеток. При нем также подчеркивается дольчатая структура клубочка.
МПГН не является диагностическим маркером для одного заболевания; это только определение конкретного типа поражения почек при воздействии различных факторов. Он был впервые описан в 1965 году, при этом были выделены два основных типа (рис. 5); через 10 лет был описан редко встречающийся третий тип, но он не имеет особых клинических проявлений.
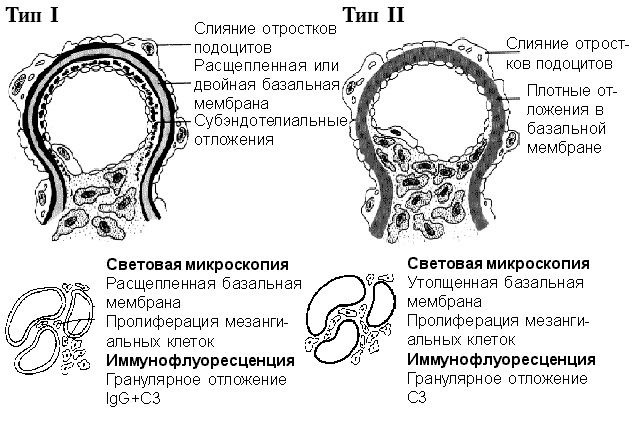
Рис.5. Мембранопролиферативный гломерулонефрит
Тип I мембранопролиферативного гломерулонефрита (с субэндотелиальными отложениям)
I тип МПГН обусловливается иммунокомплексным повреждением; он также называется мезангиокапиллярным гломерулонефритом (МКГН) с субэндотелиальными отложениями. Этот тип развивается при различных состояниях – инфекциях, опухолях, системных заболеваниях соединительной ткани, дефиците комплемента, реакциях на лекарства и генетических нарушениях. Однако у большинства больных не удается выяснить причину заболевания. Заболевание проявляется нефротическим синдромом, однако иногда развивается и гематурия. У 2/3 пациентов определяется гипокомплементемия. Хроническая почечная недостаточность развивается в течение 10 и более лет.
При световой микроскопии обнаруживается диффузное утолщение капиллярной стенки и пролиферация мезангиальных клеток. Базальная мембрана обычно расщеплена (с двойным контуром или в виде трамвайных рельсов). При иммунофлюоресценции обнаруживается отложение IgG и С3 в капиллярной стенке. При электронной микроскопии диагностическим является субэндотелиальное отложение иммунных комплексов.
Тип II мембранопролиферативного гломерулонефрита (“болезнь плотных отложений”).
Патогенез II типа МПГН, несмотря на то, что он еще не полностью раскрыт, связан с активацией комплемента по альтернативному пути без участия иммунных комплексов. Он часто развивается при различных инфекциях, однако отсутствие иммунных комплексов в электронноплотных отложениях исключает участие в развивающемся процессе иммунных комплексов. Поэтому иногда используется альтернативное название – болезнь плотных отложений.
При световой микроскопии обнаруживается эозинофильная, преломляющая свет, однообразно утолщенная базальная мембрана. Пролиферация мезангиальных клеток менее выражена, чем при I типе. При иммунофлюоресцентном исследовании обнаруживается отложение С3 в сосудистой стенке и мезангиуме. Иммуноглобулины не определяются.
Патологическая анатомия конечной стадии хронического гломерулонефрита
Макроскопически почки значительно уменьшены в размерах, кора истончена и имеет неровную, зернистую поверхность (“вторично-сморщенная почка”). На разрезе кора неравномерно истончена, граница между корой и мозговым веществом нечеткая, сосуды почки хорошо выражены из-за утолщения их стенок.
Микроскопически в истонченной коре определяется значительное уменьшение количества нефронов, диффузный склероз клубочков, многие из которых превращаются в гиалинизированные шары. Лежащие между ними канальцы атрофируются, оставшиеся канальцы расширяются и заполняются розовым белковым материалом (“тироидизация”). Часто развивается выраженный интерстициальный фиброз.
При иммунофлюоресценции и электронной микроскопии изменения могут быть различными. В некоторых склерозированных клубочках обнаруживаются отложения электронно-плотных комплексов IgA, IgG и С3. Нахождение этих отложений важно для диагностики хронического гломерулонефрита, т.к. при хроническом пиелонефрите и гипертензионном нефросклерозе, которые макро- и микроскопически могут быть похожими, таких отложений никогда не бывает.
Осложнением гломерулонефрита при его остром и подостром течении может быть олиго- или анурия. Для хронического течения гломерулонефрита характерна хроническая почечная недостаточность с проявлениями азотемической уремии. Возможны также сердечно-сосудистая недостаточность, кровоизлияние в мозг, которые становятся причиной смерти.
Фокальный гломерулосклероз
Фокальный гломерулосклероз является важной патологией, так как он является причиной нефротического синдрома у 10% детей и 15% взрослых. Причина неизвестна. Патогенез неизвестен; некоторые авторы считают его осложнением заболевания с минимальными изменениями. У некоторых больных фокальный гломерулосклероз связан с внутривенным введением героина, несколько случаев заболевания было описано у ВИЧ-инфицированных больных, у которых вирус обнаруживали в эпителиальных клетках клубочков и канальцев.
Структурные изменения. Фокальный гломерулосклероз характеризуется присутствием фокальных сегментарных склеротических зон (розовый гиалиновый материал) в периферической части клубочка. В склеротических зонах часто обнаруживаются капельки жира. Первоначально поражаются клубочки в юкстамедуллярной зоне (глубоко в коре), поэтому при поверхностной биопсии почки они не попадают в срез, в результате чего данным больным ошибочно ставиться диагноз гломерулонефрита с минимальными изменениями (предполагается, что из-за данной ошибки при биопсии большинство случаев “стероидо-резистентного” гломерулонефрита с минимальными изменениями представляют собой именно фокальный гломерулосклероз). При иммунофлюоресцентных методах исследования в пораженных клубочках находят гранулярные отложения IgM, С3, иногда IgA и фибриногена. При электронной микроскопии определяется увеличение количества мезангиального матрикса и спадение капилляров клубочка в зонах гломерулосклероза. Отростки эпителиальных клеток капсулы Боумена сливаются между собой и исчезают. В некоторых местах эпителиальный покров исчезает. Предполагается, что ведущую роль в патогенезе играет повреждение эндотелиальных клеток.
Амилоидоз почек
Почки поражаются в 80-90% случаев вторичного амилоидоза и в приблизительно 30% при первичном амилоидозе. У таких больных обнаруживается выраженная протеинурия или нефротический синдром. Почечные проявления у 50% больных являются первым проявлением заболевания.
В почках амилоид откладывается в стенках сосудов, в капиллярных петлях, что сопровождается утолщением базальной мембраны, в мезангиуме клубочков, в базальных мембранах канальцев и в строме. При электронной микроскопии выявляется специфический фибриллярный белок амилоида (АА-амилоид). Почки становятся плотными, большими и “сальными”. По мере нарастания процесса клубочки и пирамиды полностью замещаются амилоидом, разрастается соединительная ткань и развивается амилоидное сморщивание почек.
Патологическая анатомия. В течении амилоидоза почек различают следующие стадии:
- латентную;
- протеинурическую;
- нефротическую;
- азотемическую (уремическую).
В разные стадии изменения почек различны и отражают динамику процесса.
В латентной стадии внешне почки изменены мало, хотя в пирамидах (сосочках) обнаруживаются склероз и отложение амилоида по ходу прямых сосудов и собирательных трубок. Изменения клубочков состоят в утолщении и двухконтурности мембран их капилляров, просветы которых аневризматически расширены. В интермедиарной зоне и пирамидах строма пропитана белками плазмы.
В протеинурической стадии амилоид появляется не только в пирамидах, но и в клубочках в виде небольших отложений в мезангиуме и отдельных капиллярных петлях, а также в артериолах. Склероз и амилоидоз пирамид и пограничного слоя резко выражены и ведут к атрофии многих глубоко расположенных нефронов, редукции путей юкстамедуллярного кровотока и лимфотока в мозговом веществе почек. Эпителий канальцев главных отделов в состоянии гиалиново-капельной или гидропической дистрофии; в просвете канальцев обнаруживаются цилиндры. Почки увеличены, плотны, поверхность их бледно-серая или желто-серая. На разрезе корковый слой широкий, матовый, мозговое вещество серо-розовое, “сального” вида, нередко цианотичное (большая сальная почка).
В нефротической стадии количество амилоида в почках увеличивается. Он обнаруживается во многих капиллярных петлях большинства клубочков, в артериолах и артериях, по ходу собственной мембраны канальцев, однако выраженный склероз коркового вещества отсутствует. Канальцы расширены, заполнены цилиндрами. В эпителии канальцев в строме много липидов (холестерина). Почки имеют вид, типичный для так называемого амилоидно-липоидного нефроза. Они становятся большими, плотными, восковидными – большая белая амилоидная почка.
В азотемической (уремической) стадии в связи с нарастающим амилоидозом и склерозом наблюдаются гибель большинства нефронов, их атрофия, замещение соединительной тканью. Почки обычных размеров или несколько уменьшены. Они очень плотные, со множеством рубцовых западений на поверхности (амилоидно-сморщенные почки) В этой стадии нередко развивается гипертрофия сердца, особенно левого желудочка, что связано с развитием нефрогенной артериальной гипертензии.
Клинически, отложение амилоида проявляется повышением сосудистой проницаемости гломерулярных капилляров, что приводит к развитию нефротического синдрома.
Амилоидоз довольно быстро прогрессирует. Хроническая почечная недостаточность является основной причиной смерти больных амилоидозом.
ТУБУЛОПАТИИ
Тубулопатии представляют собой заболевания почек с первичным ведущим поражением канальцев, которое сопровождается нарушением их концентрационной, реабсорбционной и секреторной функции. Различают приобретенные и наследственные тубулопатии (обусловленные различными формами ферментопатий). К приобретенным тубулопатиям относят: острая почечная недостаточность (ОПН) и хронические тубулопатии (миеломная и подагрическая почка).
Морфологическим субстратом ОПН является острый некротический нефроз (ОНН); у больных при этом развивается резкая олигурия (менее 100 мл мочи в сутки). Основными причинами ОПН являются ишемия и токсическое поражение.
Ишемический ОНН может развиться при различных состояниях, например, травмах, ожогах, инфекциях, при которых развивается шоковое состояние и коллапс. Выраженная гипотензия является причиной критического понижения кровотока в почках, особенно в кортикальных клубочках в связи с особенностями их кровоснабжения. Почки выглядят бледными и отечными. При гистологическом исследовании определяется повреждение эпителиальных клеток канальцев практически по всей их длине, часто развивается вакуольная дистрофия, разрыв канальцевой базальной мембраны (тубулорексис). Интерстициум становиться отечным. Часто образуются цилиндры в дистальных канальцах и собирательных трубочках; цилиндры состоят из клеточного детрита и белков. При краш-синдроме в цилиндрах обнаруживается миоглобин, а при нарушении правил переливания крови – гемоглобин.
Различают две стадии развития заболевания. После стадии анурии, которая развивается из-за перекрытия просвета канальцев набухшими и некротизированными клетками, наступает полиурическая стадия, связанная с нарушением концентрационной способности почек. В олигурическую стадию большой риск для жизни больного представляет развивающаяся гиперкалиемия, которая может привести к аритмии сердца. Однако в начале полиурической стадии может развиться, наоборот, гипокалиемия.
Исход. Если состояние будет вовремя диагностировано и будет проведена адекватная инфузионная терапия и гемодиализ больной может полностью выздороветь. Эпителий канальцев регенерирует, если сохранена базальная мембрана. При неблагоприятном развитии процесса больные умирают от острой почечной недостаточности.
Обструктивная уропатия (гидронефроз) является частой причиной интерстициального нефрита. Причинами обструкции мочевыводящих путей могут быть:
- врожденные аномалии (мочеточниково-лоханочный стеноз, пузырно-мочеточниковый рефлюкс);
- опухоли (рак мочевого пузыря и предстательной железы);
- гиперпластические состояния (доброкачественная гиперплазия предстательной железы);
- камни.
Клинические симптомы и прогноз зависят от уровня обструкции. Так, например, камень или фрагмент оторвавшегося сосочка может стать причиной почечной колики, а рак мочевого пузыря или доброкачественная гиперплазия предстательной железы проявиться пузырными симптомами. Острая обструкция нижних отделов мочевого тракта приведут к анурии и болям.
Частичная или односторонняя обструкция может протекать скрытно, иногда бессимптомно в течении нескольких лет. Проявляется она полиурией и никтурией. На ранних стадиях определяется снижение концентрационной функции почек, канальцевый ацидоз и отложение большого количества солей. Часто развивается гипертензия.
Патогенез. Лоханка и чашечки становятся расширенными в результате повышения давления; при острой обструкции расширение выражено не сильно. Перистальтическая активность мочеточников повышается, что приводит к повышению внутрилоханочного давления, которое передается на паренхиму. Первоначально образующийся ультрафильтрат реадсорбируется через лимфатические и кровеносные сосуды. При продолжающемся быстром повышении давления происходит снижение кровотока в клубочках и мозговом слое, что приводит к нарушению фильтрации. В результате длительной обструкции развивается сильное расширение лоханки с истончением паренхимы (гидронефроз).
ПИЕЛОНЕФРИТ
Пиелонефрит – это инфекционное заболевание, при котором инфекция может попадать в почки гематогенным (нисходящим) или уриногенным (восходящим) путем. В результате обильного кровоснабжения почек они часто поражаются при различных состояниях, сопровождаемых септицемией. Наиболее часто возбудителями являются бактерии. Инфекции мочевых путей встречаются достаточно часто, занимая второе место после инфекций дыхательных путей. Однако не при всех инфекциях мочевыводящих путей может развиться пиелонефрит, для его развития необходим пузырно-мочеточниковый рефлюкс.
Распространенность пиелонефрита коррелирует с частотой различных обструкций мочевых путей. В детстве чаще болеют мальчики, т.к. у них чаще встречаются различные аномалии строения мочевыводящих путей. С пубертатного периода до средних лет чаще болеют женщины, что связано с более частыми травмами мочеиспускательного канала и беременностью. После 40 лет чаще болеют мужчины из-за развития различных заболеваний предстательной железы. Также предрасполагающими факторами являются инструментальные обследования и манипуляции (например, катетеризация и цистоскопия) и сахарный диабет.
Острый пиелонефрит развивается при инфицировании пиогенными микроорганизмами. Начинается заболевание с высокой лихорадки, озноба и боли в пояснице. Дизурические проявления говорят о наличии также инфекции нижних отделов мочевыводящей системы. В моче определяется легкая протеинурия (до 1 г/л), лейкоцитоз, лейкоцитарные (белые) цилиндры и бактерии. Диагноз подтверждают бактериологическим исследованием. Наличие более 100000 микроорганизмов в 1 мл мочи является диагностическим. Острый пиелонефрит встречается во всех возрастах, однако, наиболее часто после начала половой жизни и во время беременности.
Этиология и патогенез. Инфицирование почек может происходить гематогенным (нисходящим) или уриногенным (восходящим) путем. Гематогенный занос инфекции встречается довольно редко. Гематогенный занос может происходить при инфекционном эндокардите или бактериемии из других источников; спектр микроорганизмов широкий, включающий бактерии, грибы и вирусы.
Чаще пиелонефрит развивается в результате восходящего распространения инфекции. Основными способствующими факторами являются:
- рефлюкс с нижних отделов мочевыводящей системы;
- короткая уретра у женщин;
- стаз мочи любой этиологии;
- пузырно-мочеточниковый рефлюкс. У 50% детей и подростков с пиелонефритом обнаруживается это состояние, которое является наследственным в результате нарушения вхождения мочеточника в мочевой пузырь.
- катетеризация мочевого пузыря.
- сахарный диабет
Наиболее частые возбудители – Escherichia coli, Proteus и Enterobacter. При возникновении заболевания после катетеризации спектр микроорганизмов может быть достаточно широким: Klebsiella, Proteus, Enterococcus faecalis, Pseudomonas aeruginosa и др.
Высокая заболеваемость мочевыми инфекциями при беременности связана с повышенным содержанием в крови прогестерона, который понижает сократительную активность гладкой мускулатуры, что приводит к стазу мочи.
Морфология. Острый пиелонефрит может быть как двух-, так и односторонним. Почки увеличены в размерах, в коре обнаруживаются зоны нагноения (абсцессы) с желтыми радиальными полосами, пресекающими мозговое вещество. При гематогенном пиелонефрите небольшие абсцессы располагаются хаотично, преимущественно в верхнем, а при уриногенном заносе инфекции – в нижнем полюсе почки. Также может наблюдаться воспаление чашечек и лоханок, что сопровождается накоплением гноя в просвете лоханок.
При гистологическом исследовании обнаруживаются полиморфноядерные лейкоциты в просвете канальцев, отек и воспаление интерстиция. При заживлении развивается фиброз интерстициума и в воспалительном инфильтрате начинают преобладать лимфоциты и плазмоциты.
Осложнения. При остром пиелонефрите могут развиться следующие осложнения:
Некроз сосочков почки. В результате воспаления может нарушаться кровоснабжение мозгового слоя, что приводит к инфаркту сосочков. Некротизированные сосочки отторгаются в просвет лоханки. Данное осложнение наиболее часто встречается у диабетиков.
Пионефроз. Он развивается при высокой обструкции мочеточников (на границе с почкой). При этом жидкость в лоханке и чашечках нагнаивается. Почки становятся увеличенными, заполненными гноем.
Околопочечный абсцесс. При проникновении инфекции через капсулу почки происходит нагноение околопочечной клетчатки.
Хронический пиелонефрит является причиной хронической почечной недостаточность у 15% пациентов.
Различают хронический обструктивный пиелонефрит и хронический пиелонефрит, связанный с пузырно-мочеточниковым рефлюксом.
Хронический обструктивный пиелонефрит встречается довольно часто и наблюдается во всех возрастных группах. Обструкция может быть механической (например, камнями, при гиперплазии предстательной железы, опухолях, врожденных аномалиях, забрюшинном фиброзе) или обусловлена парезом стенки мочевого пузыря (нейропатический мочевой пузырь). У 50% больных в анамнезе имел место острый пиелонефрит.
Морфология. Поражение почек обычно асимметричное, определяется различной степени выраженности сморщивание почек в основном на полюсах. Часто наблюдается деформация чашечно-лоханочной системы. Хронический пиелонефрит отличается от хронического гломерулонефрита асимметричностью поражения и наличием глубоких рубцов в коре. В области сморщивания наблюдается деформация и расширение чашечек.
Микроскопически определяется интерстициальный фиброз с атрофией и расширение трубочек, в которых обнаруживаются эозинофильные цилиндры, что приводит к появлению своеобразной гистологической картины, напоминающей строение щитовидной железы, поэтому такие изменения называются “тиреоидизацией” почек.
При микроскопии обнаруживаются очаги воспаления и фиброза в интерстиции. Воспалительный экссудат в основном состоит из лимфоцитов и плазмоцитов с небольшой примесью нейтрофилов. Перигломерулярный склероз прогрессирует с развитием глобального склероза нефрона. Может наблюдаться гипертрофия и дилатация выживших канальцев (этот процесс называется тиреодизацией, т.к. на первый взгляд многочисленные плотно расположенные расширенные канальцы напоминают фолликулы щитовидной железы. При иммунофлюоресценции и электронной микроскопии не обнаруживаются иммунные комплексы в клубочках.
При преобладании в экссудате макрофагов, имеющих пенистую цитоплазму, говорят о ксантогранулематозном пиелонефрите. Ксантогранулематозный пиелонефрит – это редкое состояние, которое развивается у больных с хроническим пиелонефритом, вызванном Proteus и E. coli. При ксантогранулематозном воспалении происходит увеличение почек и образование в лоханке больших коралловидных камней. Клиническое значение данного состояния состоит в том, что его можно спутать с раком почки. Часто воспалительный процесс распространяется на окружающие органы (например, кишечник, кожу спины, диафрагму и плевру). Иногда могут формироваться фистулы между лоханкой почки и этими органами.
ХРОНИЧЕСКАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Хроническая почечная недостаточность, характеризуемая повышением концентрации в крови азотистых шлаков (азотемическая уремия) и другими признаками, такими как анемия, тошнота, рвота, желудочно-кишечные кровотечения и кожный зуд; часто наблюдаются полиурия и никтурия. Пациентов с ХПН делят на две группы: у одних установлено почечное заболевания, которое привело к деструкции паренхимы, у других ХПН развивается de novo на фоне заболевания, острая фаза которого не проявлялась клинически.
Клинические проявления ХПН развиваются в результате нарушения нормальной функции почек. Накопление азотистых шлаков происходит в результате снижение фильтрации крови в почках. Анемия развивается в результате снижения продукции почками эритропоэтинов под воздействием уремических токсинов, истощения костного мозга, а также из-за гематурии и гемолиза. С помощью генной инженерии удалось воссоздать структуру эритропоэтинов и синтезировать их вне организма, что позволило корригировать данное проявление ХПН. У больных часто развивается остеодистрофия, очень напоминающая поражение костей при рахите, которая развивается в результате нарушения метаболизма витамина D в пораженных почках, что приводит к снижению всасывания кальция в кишечнике и является причиной стимуляции паращитовидных желез. Процесс осложняется также задержкой фосфатов в организме. Это проявление можно лечить активным метаболитом витамина D1-альфа-гидроксихолекальциферолом. По мере фиброзирования почки продукция ренина повышается, что приводит к развитию гипертензии.
При вскрытии трупа умершего от уремии ощущается запах мочи. Кожа серо-землистой окраски в результате накопления урохрома. Иногда, особенно на лице, она бывает как бы припудрена беловатым порошком (хлориды, кристаллы мочевины и мочевой кислоты). Иногда обнаруживаются очаговые кровоизлияния и петехиальная сыпь как выражение геморрагического диатеза. Часто обнаруживается уремический ларингит, трахеит, пневмония, которые имеют чаще фибринозно-некротический или фибринозно-геморрагический характер. Также можно встретить полисерозит, фарингит, гастрит, энтероколит катарального, фибринозного или фибринозно-геморрагического характера. Причиной их развития служит заместительное выделение серозными оболочками и слизистыми этих органов мочевины, которая, превращаясь в аммиак, оказывает раздражающее действие и вызывает воспалительную реакцию. В печени возникает жировая дистрофия. Селезенка увеличена, напоминает септическую.
Очень часто обнаруживаются серозный, серозно-фибринозный или фибринозный перикардит, уремический миокардит, реже – бородавчатый эндокардит. Возможно развитие уремического плеврита и перитонита.
Головной мозг при уремии бледный и отечный, иногда появляются очаги размягчения и кровоизлияния.
ОБНОВЛЕНИЯ
ПОДПИСАТЬСЯ НА РАССЫЛКУ
ПРЕДМЕТЫ
- Анатомия
- Акушерство и гинекология
- БЖД, медицина катастроф
- Биохимия
- Биология
- Гистология
- Гигиена
- Генетика
- Диетология
- Дерматовенерология
- Инфекционные болезни
- Культурология
- Лабораторная диагностика
- Летняя практика
- Лучевая диагностика
- Медицинская информатика
- Микробиология
- Неврология
- Общественное здоровье
- Общий уход
О НАС
«Dendrit» - информационный портал для медицинских работников, студентов медицинских ВУЗов, исследователей и пациентов.
Ваш источник новостей и знаний о здоровье.