ПОДПИСАТЬСЯ НА РАССЫЛКУ
Генетические механизмы старения
Старение – будет всегда актуальным вопросом для человечества. Столетиями ученые бьются над этим вопросом, пытая разгадать его механизмы. Основным прогрессивным направлением изучения генетических механизмов является теломерная теория.
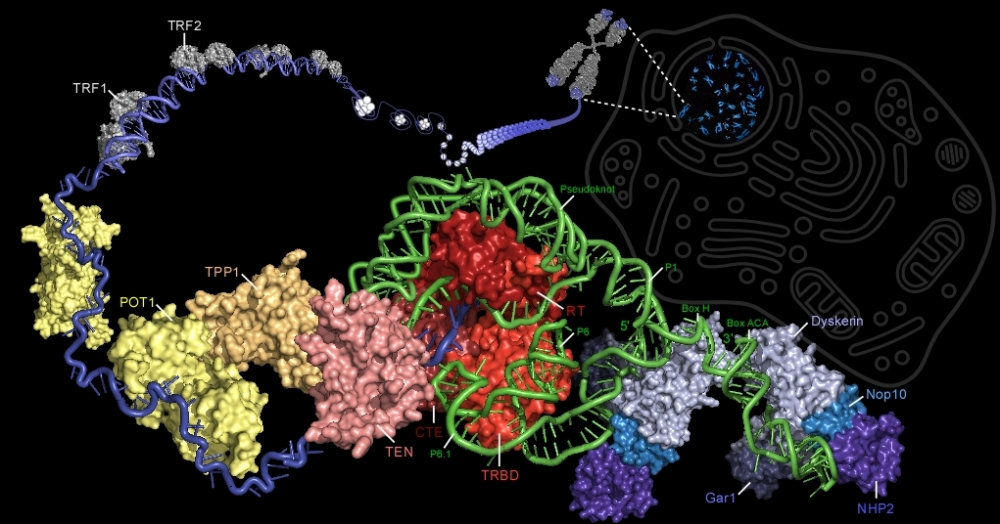
Еще в 1881 году классик цитологии Август Вейсман постулировал: «Старение организма происходит потому, что у соматических клеток способность к росту путем деления не вечна, а ограничена». При этом Вейсман делал исключение для половых клеток, говоря, что они не стареют. Его утверждения не подкреплены экспериментально.
В 1961г. Леонард Хейфлик вместе с Полом Мурхедом начали работу с культурами фибробластов из человеческих эмбрионов, изменив экспериментальные методы своих предшественников. Теперь исходный материал обрабатывали трипсином для диссоциации ткани на отдельные клетки и питательная среда больше не содержала экстракта эмбрионов и плазму, а представляла собой смесь низкомолекулярных питательных веществ. Нормальные соматические клетки, внесенные в такую среду и инкубируемые в термостате через несколько часов прикреплялись ко дну сосуда, образуя монослой, а через день начинали делиться. Деление прекращалось контактным торможением. После чего клетки вновь обрабатывались трипсином и половину клеток вновь вносили в очередной «матрац» с питательной средой. В этих экспериментах было выявлено, что фибробласты, взятые от человеческого эмбриона не могут делиться сколько угодно. Также было определено, что это не случайность, а закономерность: деление прекращается примерно после 50 пересевов. Это критическое деление получило название лимита Хейфлика.
Также были приведены и другие аргументы Хейфлика:
- Если получить фибробласты от взрослого человека, то число делений клеток до гибели популяции оказывается меньше 50. Из чего следует, что in vivo в клетках тоже функционирует некий счетчик, фиксирующий количество делений.
- С увеличением возраста донора на один год, количество возможных делений фибробластов в культуре уменьшается в среднем на 0.2. Итого, за 100 лет жизни человека репликативный потенциал фибробластов снижается только на 20 делений, а весь потенциал израсходуется только за 250 лет.
- Даже после глубокого заморожения, клетки делятся столько раз – сколько им оставалось делиться.
- Также была выявлена корреляция между видовой продолжительностью жизни животного и количеством делений его клеток в культуре.
Исходя из этих фактов можно было бы сделать вывод, что делящимся клеткам человека и животных, действительно, соответствует некий генетически детерминированный лимит деления.
В 1971 году открытие Хейфлика стало общепризнанным, и в то же время Алексей Матвеевич Оливников обратил внимание на то, что для репликации теломерных отделов ДНК должен существовать специальный механизм, что и натолкнуло его на теломерную теорию старения. Согласно данной, во всех соматических клетках организма механизм репликации теломер отсутствет, поэтому при делении клеток теломеры постепенно укорачиваются, а при приближении длины теломер к критическому уровню клетки начинают стареть, а по достижению этого уровня – погибают.
Таким образовам эффект Хейфлика объяснялся укорочением хромосм, и одновременно к этому эффекту сводится основная суть старения.
Предположение об укорочении теломер в соматических клетках блестяще подтвердилось. Было обнаружено, что при каждом делении нормальных клеток в культуре длина теломер последовательно сокращается. Также были исследованы половые клетки, в них теломеры оказывались длиннее, чем в соматических клетках того же индивидуума.
Исходя из современных исследований, можно выделить, что ДНК эукариотических хромосом является линейной, и так как ДНК-полимераза может начинать синтез ДНК лишь при наличии РНК-праймера и ведет его в направлении от 5’ к 3’, несколько нуклеотидов на 3’-концах обеих матричных цепей не реплицируются.
Как следствие теломеры хромосом при каждом раунде репликации, закономерно сопровождающем деление клетки, должны терять определенное число нуклеотидов.
У одноклеточных организмов, недифференцированных и трансформированных клеток, а также некоторых зрелых клеток, в частности активированных Т-лимфоцитов, данную потерю компенсирует восстановление нуклеотидных последовательностей теломер особым ферментом с обратно-транскриптазной активностью — теломеразой.
Теломераза – это особая обратная транскриптаза, работающая в комплексе со специальной теломеразной РНК.
Теломераза может добавлять несколько теломерных повторов за один акт присоединения к олигонуклеотидному субстрату.
Цикл реакций теломеразы in vitro включает следующие стадии: связывание праймера, элонгацию, транслокацию, и диссоциацию.
Большинство нормальных клеток многоклеточных организмов, во время дифференцировки утрачивают активность теломеразы, и поэтому при каждом делении их теломеры все больше укорачиваются, из-за чего общее число делений таких клеток не может превысить лимит Хейфлика.
В 1998году было экспериментально доказано, что при введении гена TERT, кодирующим каталическую субъединицу теломеразы клетки превысили лимит Хейфлика на 20 единиц.
Но нельзя сказать, что теломерная теория полноценно описывает старение, напротив: старение это неизмеримо более сложный и многогранный процесс. В организме кроме делящихся есть много неделящихся клеток (клетки мозга, печени, мышечные волокна), причем они тоже стареют и по многим данным не медленней, а даже быстрее делящихся клеток. В этом случае нельзя сказать, что старение и гибель обусловлены именно лимитом деления. При этом экспериментальные данные, согласно которым даже у пожилых людей репликативный потенциал делящихся клеток далеко не исчерпан. Фибробласты, выделенные у 90летних доноров делились всего на 20 раз меньше, чем фибробласты плодов человека. Тогда как лимит Хейфлика равен 50.
Кроме этого, как известно, стволовые клетки человека за 60 лет жизни делятся более чем 400 раз.
Главное, с чем трудно согласиться, - то, что все старение соматических клеток сводится к выключению в них всего одного гена (гена теломеразы), и, соответственно отсутствие всего одного фермента (самой теломеразы).
Недавно внимание ученых привлек ген FoxO у кишечно-полостных, в частности у пресноводнонр полипа гидры, которая в отличие от других животных бессмертен. Это связано с тем, что размножаются гидры почкованием и каждая дочерняя особь обязательно должна содержать такие же активные стволовые клетки, как и материнская особь предыдущего поколения. Таким образом стволовые клетки гидр не изменяются в течение времени - они не стареют. Их способность «обновлять» ткани тела остается постоянной, и их количество в теле не уменьшается. Поэтому гидра умирает, только если ее кто-нибудь съест или если она заболеет чем-нибудь смертельным.
Исследователи рассмотрели несколько модификаций гидры с различными уровнями генов FoxO - нормальным, неактивным и повышенным.
При увеличении активности гена FoxO методом генной инженерии, было выявлено, что стволовые клетки начинают делиться еще больше и активнее.
Ну а если этот ген «выключить», гидры начинают размножаться гораздо медленнее и у них происходят изменения в иммунной системе, то есть вещи типичные для стареющих организмов. Получается, что ген FoxO важен для поддержания стволовых клеток в активном здоровом виде у всех животных. Данная работа объясняет молекулярный механизм того, почему гидры могут жить вечно. FoxO наиболее активен у людей старше ста лет, именно поэтому специалисты полагают, что ген играет ключевую роль в процессе старения не только гидр, но и людей. Но проверка этой гипотезы на человеке пока не проводилась, так как это потребует генетических манипуляций, опасных для здоровья.
Но исследование гена FoxO и теломерной теории старения не сводится к нахождению ответа о вечной молодости. Известно, что теломераза активна в 85% типов раковых опухолей. И как следствие, уже с первых лет исследования теломеразы, фермент стали считать универсальной мишенью, которую можно использовать при разработке антираковой терапии.
Одним из решения проблемы лечения злокачественных пролиферативных болезней может стать нахождение соответствующего эффективного ингибитора теломеразной активности.
Исследование и более глубокое изучение генетических механизмов старения в медицинских ВУЗах является перспективным направлением, так как может открыть механизмы еще пока неизлечимых болезней, таких как рак и атеросклероз, так как их развитие предопределено генетическими механизмами.
ПОДПИСАТЬСЯ НА РАССЫЛКУ
ПРЕДМЕТЫ
- Анатомия
- Акушерство и гинекология
- БЖД, медицина катастроф
- Биохимия
- Биология
- Гистология
- Гигиена
- Генетика
- Диетология
- Дерматовенерология
- Инфекционные болезни
- Культурология
- Лабораторная диагностика
- Летняя практика
- Лучевая диагностика
- Медицинская информатика
- Микробиология
- Неврология
- Общественное здоровье
- Общий уход
О НАС
«Dendrit» - информационный портал для медицинских работников, студентов медицинских ВУЗов, исследователей и пациентов.
Ваш источник новостей и знаний о здоровье.
Комментарии могут оставлять только зарегистрированные пользователи!Пока нет комментариев