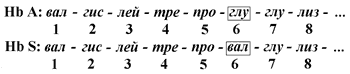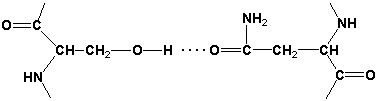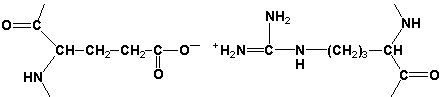ПОДПИСАТЬСЯ НА РАССЫЛКУ
Уровни структурной организации белковой молекулы. Функции белков.
Тема: «УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКОВОЙ МОЛЕКУЛЫ. ФУНКЦИИ БЕЛКОВ»
1. Строение аминокислот, входящих в состав белка. Классификация аминокислот, основанная на свойствах их радикалов.
2. Первичная структура белка. Пептидная связь, особенности её образования, правила написания и номенклатура пептидов. Растворимость пептидов в воде и органических растворителях.
3. Понятие об уровнях структурной организации белковых молекул, типы химических связей, стабилизирующих каждый уровень. Примеры фибриллярных и глобулярных белков.
4. Физико-химические свойства белков (молекулярная масса, изоэлектрическая точка, растворимость в воде). Денатурация белков: факторы, вызывающие денатурацию; примеры использования процесса денатурации в медицине.
5. Функции белков (примеры). Взаимодействие белков с лигандами как основа функционирования белков.
6. Понятие о простых и сложных белках. Простые белки: протамины, гистоны, альбумины, глобулины, коллаген, эластин, кератин (особенности аминокислотного состава, моле-кулярная масса, конформация, растворимость в воде).
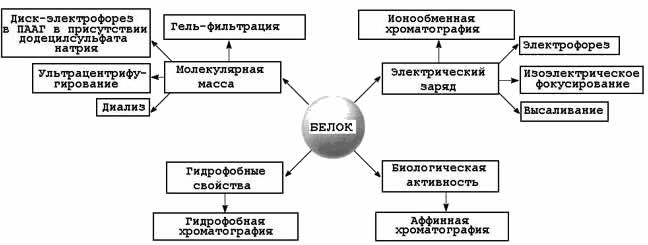
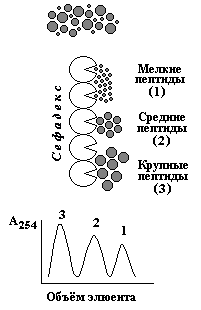
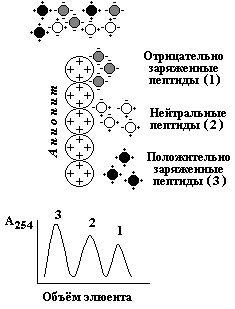
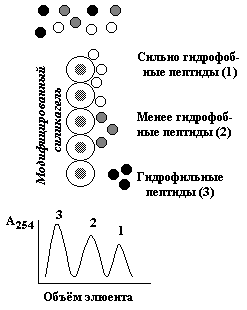
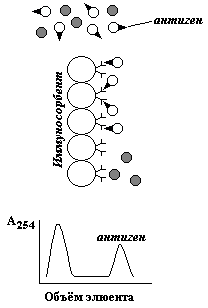
7. Понятие о методах разделения белков: хроматографические методы (гель-фильтрация, ионообменная, гидрофобная, аффинная хроматография); электрофоретические методы; ультрацентрифугирование, высаливание, диализ. Примеры использования методов разделения белков в медицине и фармации.
| Раздел 2.1 |
Уровни структурной организации белков. Типы связей, формирующих каждую структуру. Варианты структурной организации в пределах каждого уровня. |
|
|
|
|
Принято выделять четыре уровня структурной организации белковой молекулы: первичная, вторичная, третичная и четвертичная структура. Рассмотрим особенности каждого из этих уровней. 2.1.1. Первичной структурой белка называют последовательность чередования аминокислот в полипептидной цепи. Эту структуру формируют пептидные связи между α-амино- и α-карбоксильными группами аминокислот (см. 1.4.2). Имейте в виду, что даже небольшие изменения первичной структуры белка могут значительно изменять его свойства. Примером заболеваний, развивающихся в результате изменения первичной структуры белка, являются гемоглобинопатии (гемоглобинозы) . В эритроцитах здоровых взрослых людей присутствует гемоглобин А (Hb А) . В крови некоторых людей содержится аномальный (изменённый) гемоглобин - гемоглобин (Hb S). Единственное отличие первичной структуры Hb S от Hb A - замена гидрофильного остатка глутаминовой кислоты на гидрофобный остаток валина в концевом участке их β-цепей:
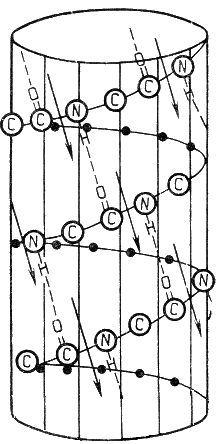
Как известно, основная функция гемоглобина -транспорт кислорода к тканям. В условиях пониженного парциального давления О2 снижается растворимость гемоглобина S в воде и его способность связывать и переносить кислород. Эритроциты принимают при этом серповидную форму, быстро разрушаются, вследствие чего развивается малокровие (серповидно-клеточная анемия] . Установлено, что последовательность аминокислотных остатков полипептидной цепи белка несёт в себе информацию, необходимую для формирования пространственной структуры белка. Установлено, что каждой полипептидной последовательности соответствует только один стабильный вариант пространственной структуры. Процесс сворачивания полипептидной цепи в правильную трёхмерную структуру получил название фолдинг. До последнего времени считалось, что формирование пространственной структуры белка происходит самопроизвольно, без участия каких-либо компонентов. Однако сравнительно недавно обнаружилось, что это справедливо только для сравнительно небольших белков (порядка 100 аминокислотных остатков). В процессе фолдинга более крупных белков принимают участие специальные протеины - шапероны, которые создают возможность быстрого формирования правильной пространственной структуры белка. 2.1.2. Вторичная структура белка представляет собой способ свёртывания полипептидной цепи в спиральную или иную конформацию. При этом образуются водородные связи между СО-и NH-группами пептидного остова одной цепи или смежных полипептидных цепей. Известно несколько типов вторичной структуры пептидных цепей, среди которых главными являются α-спираль и β-складчатый слой. α-Спираль - жёсткая структура, имеет вид стержня. Внутреннюю часть этого стержня создаёт туго закрученный пептидный остов, радикалы аминокислот направлены наружу. При этом СО-группа каждого аминокислотного остатка взаимодействует с NH-группой четвёртого от него остатка. На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм (рисунок 2.1).
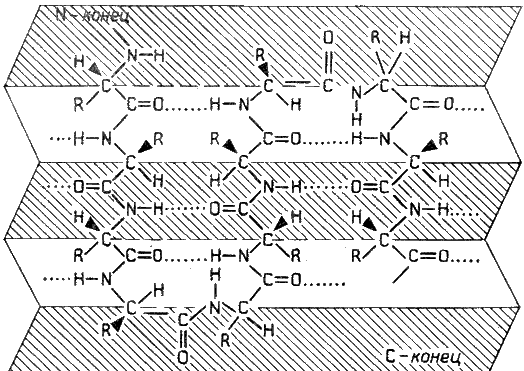
Рисунок 2.1. α-Спираль. Некоторые аминокислоты препятствуют свёртыванию цепи в α-спираль, и в месте их расположения непрерывность спирали нарушается. К этим аминокислотам относятся пролин (в нём атом азота входит в состав жёсткой кольцевой структуры и вращение вокруг связи N - Сα становится невозможным) , а также аминокислоты с заряженными радикалами, которые электростатически или механически препятствуют формированию α-спирали. Если в пределах одного витка (примерно 4 аминокислотных остатка) находятся два таких радикала (или более), они взаимодействуют и деформируют спираль. β-Складчатый слой отличается от α-спирали тем, что имеет плоскую, а не стержневидную форму. Образуется при помощи водородных связей в пределах одной или нескольких полипептидных цепей. Пептидные цепи могут быть расположены в одном направлении (параллельно) или в противоположных направлениях (антипараллельно) , напоминая меха аккордеона. Боковые радикалы находятся выше и ниже плоскости слоя.
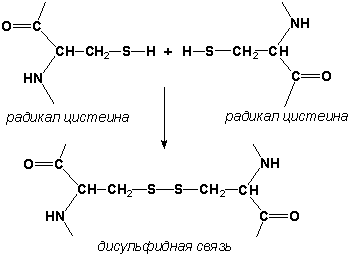
Рисунок 2.2. β-Складчатый слой. Обратите внимание на то, что тип вторичной структуры белка определяется его первичной структурой. Например, в месте расположения остатка пролина (атомы пирролидинового кольца в пролине лежат в одной плоскости) пептидная цепь делает изгиб, и водородные связи между аминокислотами не образуются. Поэтому белки с высоким содержанием пролина (например, коллаген) не способны образовывать а-спираль. Радикалы аминокислот, несущие электрический заряд, также препятствуют спирализации. 2.1.3. Третичная структура белка - это распределение в пространстве всех атомов белковой молекулы, или иначе говоря, пространственная упаковка спирализованной полипептидной цепи. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот.
По форме молекулы и особенностям формирования третичной структуры белки делят на глобулярные и фибриллярные. Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). К глобулярным белкам относятся:
Фибриллярные белки - имеют нитевидную форму (фибриллы) , образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей. К фибриллярным белкам относятся:
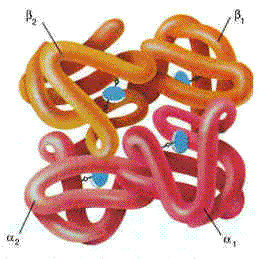
2.1.4. Четвертичная структура белка - размещение в пространстве взаимодействующих между собой субъединиц, образованных отдельными полипептидными цепями белка.Четвертичная структура - высший уровень организации белковой молекулы, к тому же необязательный - более половины известных белков её не имеют. Белки, обладающие четвертичной структурой, называют также олигомерными белками, а полипептидные цепи, входящие в их состав, - субъединицами или протомерами. В некоторых белках такие субъединицы одинаковы или имеют сходное строение, а другие белки состоят из субъединиц с цепями разных типов. Каждый из протомеров синтезируется в виде отдельной полипептидной цепи, которая сворачивается в глобулу и затем объединяется с другими путём самосборки. Каждая субъединица содержит участки, способные взаимодействовать с соответствующими участками других субъединиц. Эти взаимодействия осуществляются посредством водородных, ионных и гидрофобных связей между радикалами аминокислот, входящих в состав разных цепей. Олигомерные белки могут существовать в виде нескольких устойчивых конформаций и обладают аллостерическими свойствами, то есть способны переходить из одной конформаций в другую с изменением своей функциональной активности. Примерами олигомерных белков могут служить эритроцитарный белок гемоглобин, фермент фосфофруктокиназа и многие другие. Более подробно структурная организация и функционирование олигомерных белков будут рассмотрены в следующей теме на примере гемоглобина (рисунок 2.3).
Рисунок 2.3. Пространственное строение гемоглобина. В состав его молекулы входят четыре попарно одинаковые субъединицы, обозначаемые буквами α и β. Небелковая часть гемоглобина — гем — показана синим цветом. Известны также белки, модекула которых состоит из двух или более полипептидных цепей, соединённых дисульфидными связями (инсулин, тромбин). Подобные белки нельзя олигомерными. Такие белки образуются из единой полипептидной цепи в результате частичного протеолиза - локального расщепления пептидных связей. Аллостерическими свойствами, характерными для олигомерных белков, такие белки не обладают. |
|
| Раздел 2.2 |
Функции белков. Специфическое взаимодействие белков с лигандами. Ингибиторы белковых функций. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2.2.1. Белки играют важнейшую роль в организме, выполняя многообразные биологические функции.Запомните наиболее важные из них и примеры соответствующих белков, изучив таблицу 2.2.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ОБНОВЛЕНИЯ
ПОДПИСАТЬСЯ НА РАССЫЛКУ
ПРЕДМЕТЫ
- Анатомия
- Акушерство и гинекология
- БЖД, медицина катастроф
- Биохимия
- Биология
- Гистология
- Гигиена
- Генетика
- Диетология
- Дерматовенерология
- Инфекционные болезни
- Культурология
- Лабораторная диагностика
- Летняя практика
- Лучевая диагностика
- Медицинская информатика
- Микробиология
- Неврология
- Общественное здоровье
- Общий уход
О НАС
«Dendrit» - информационный портал для медицинских работников, студентов медицинских ВУЗов, исследователей и пациентов.
Ваш источник новостей и знаний о здоровье.