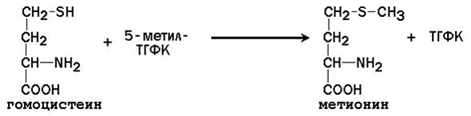Тема: «ОСОБЕННОСТИ ОБМЕНА ГЛИЦИНА, СЕРИНА, СЕРУСОДЕРЖАЩИХ И АРОМАТИЧЕСКИХ АМИНОКИСЛОТ»
1. Пути образования и использования глицина и серина в организме. Роль тетрагидрофолиевой кислоты в образовании и переносе одноуглеродных групп.
2. Пути образования и использования цистеина в организме. S-Аденозилметионин, его участие в реакциях переноса метильных групп. Роль метилкобаламина и метил-ТГФК в регенерации метионина в организме. Метильная конъюгация.
3. Биосинтез креатина и креатинфосфата, биологическая роль. Образование и выделение креатинина. Клинико-диагностическое значение определения содержания креатина и креатинина в крови и моче.
4. Обмен фенилаланина и тирозина, особенности их катаболизма, участие в синтезе гормонов, нейромедиаторов и пигментов. Особенности катаболизма фенилаланина и тирозина.
5. Врождённые нарушения обмена фенилаланина и тирозина (фенилкетонурия, алкаптонурия, альбинизм): основные симптомы, биохимическая диагностика, особенности диеты.
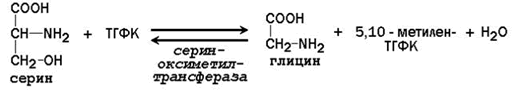
Обмен серина и глицина. Образование и перенос одноуглеродных групп.
Главную роль в реакциях обмена серина и глицина играют ферменты, в состав которых в качестве кофермента входит тетрагидрофолиевая кислота (ТГФК). ТГФК образуется в организме в результате восстановления фолиевой кислоты (витамина Вс).
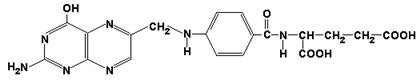
фолиевая кислота
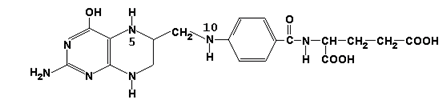
ТГФК
25.1.2. Реакционноспособными центрами в молекуле ТГФК являются атомы азота в положениях 5 и 10. Атомы водорода при N5 и N10 могут замещаться на различные одноуглеродные группы: метильную (-СН3), метиленовую (-СН2-), метенильную (=СН-), формильную (-СН=О) и некоторые другие. Основными источниками одноуглеродных групп в клетке служат серин и глицин.
5,10-Метилен-ТГФК используется как донор метильной группы в реакциях биосинтеза тимидилового нуклеотида.
При окислении 5,10-метилен-ТГФК образуются 5,10-метенил-ТГФК и 10-формил-ТГФК. Эти производные ТГФК служат источниками атомов углерода в процессе биосинтеза пуриновых нуклеотидов (аденилового и гуанилового).
При восстановлении 5,10-метилен-ТГФК образуется 5-метил-ТГФК. Это соединение интересно тем, что может поставлять метильную группу для регенерации метионина из гомоцистеина (см. далее).
25.1.3. Аминокислота глицин, помимо участия в синтезе белка и образовании различных одноуглеродных групп, является предшественником ряда специализированных биомолекул:
- оба атома углерода и атом азота глицина могут включаться в структуру пуринового ядра (атомы С4, С5 и N7);
- глицин является главным предшественником порфиринов (простетической группы гемоглобина, миоглобина, цитохромов);
- глицин участвует в синтезе креатина - предшественника креатинфосфата, участвующего в биоэнергетике мышечной и нервной ткани;
- глицин входит в состав пептидного кофермента глутатиона;
- участвует в образовании конъюгатов (гликохолевая кислота, гиппуровая кислота).
Обмен метионина и цистеина. Реакции трансметилирования
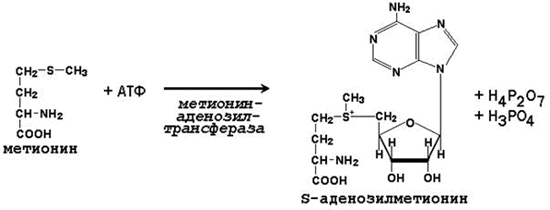
Метильная группа метионина, связанная с атомом серы, также представляет собой подвижную одноуглеродную группу, способную участвовать в реакциях трансметилирования (переноса метильной группы). Активной формой метионина, принимающей непосредственное участие в этих превращениях, является S-аденозилметионин, который образуется при взаимодействии метионина с АТФ.
Примеры реакций трансметилирования с участием S-аденозилметионина приводятся в таблице 25.1.
Таблица 25.1
Использование метильной группы S-аденозилметионина в реакциях трансметилирования
| Субстрат | Метилированный продукт |
| Норадреналин |
Адреналин |
| Адреналин |
Метоксиадреналин |
| Гуанидинацетат |
Креатин |
| Карнозин |
Ансерин |
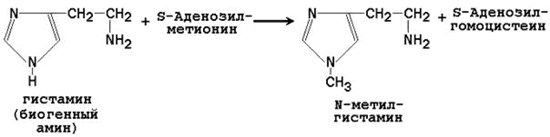
| Гистамин |
N-метилгистамин |
| Фосфатидилэтаноламин |
Фосфатидилхолин |
Вот некоторые примеры этих реакций.
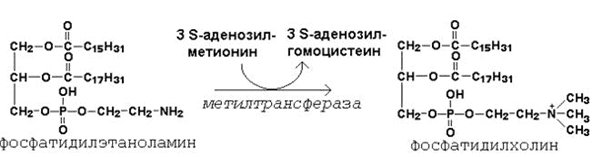
1) Образование фосфатидилхолина из фосфатидилэтаноламина - ключевая реакция синтеза фосфолипидов:
Фосфатидилхолин – главный фосфолипидный компонент биологических мембран; он входит в состав липопротеинов, принимает участие в транспорте холестерола и триацилглицеролов; нарушение синтеза фосфатидилхолина в печени приводит к жировой инфильтрации.
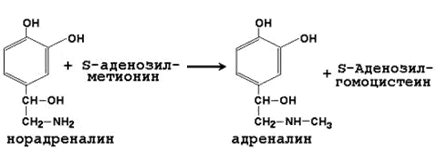
2) Образование адреналина из норадреналина - заключительная реакция синтеза гормона мозгового вещества надпочечников:
Адреналин выделяется в кровь при эмоциональном стрессе и участвует в регуляции углеводного и липидного обмена в организме.
3) Реакции метильной конъюгации - один из этапов обезвреживания чужеродных соединений и эндогенных биологически активных веществ:
В результате метилирования блокируются реакционноспособные SH- и NН-группы субстратов. Продукты реакции не обладают активностью и выводится из организма с мочой.
25.2.3. После отдачи метильной группы S-аденозилметионин превращается в S-аденозилгомоцистеин. Последний расщепляется на аденозин и гомоцистеин. Гомоцистеин может вновь превращаться в метионин за счёт метильной группы 5-метил-ТГФК (см. предыдущий параграф):
В этой реакции в качестве кофермента участвует метилкобаламин – производное витамина В12. При недостатке витамина В12 нарушается синтез метионина из гомоцистеина и накапливается 5-метил-ТГФК. Так как реакция образования 5-метил-ТГФК из 5,10-метилен-ТГФК необратима, одновременно возникает дефицит фолиевой кислоты.
25.2.4. Другим путём использования гомоцистеина, как уже упоминалось, является участие в синтезе цистеина. Биологическая роль цистеина:
- входит в состав белка, где может образовывать дисульфидные связи, стабилизирующие пространственную структуру макромолекулы;
- участвует в синтезе глутатиона, причём цистеиновая SH-группа определяет реакционную способность этого кофермента;
- является предшественником тиоэтаноламина в молекуле HS-КоА;
- служит предшественником таурина в конъюгированных желчных кислотах;
- является источником атома серы в органических сульфатах (хондроитинсульфат, гепарин, ФАФС).
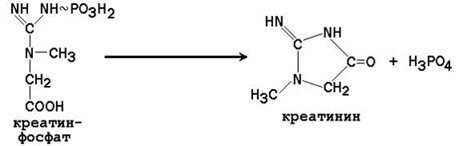
Биосинтез креатина и его последующие превращения.
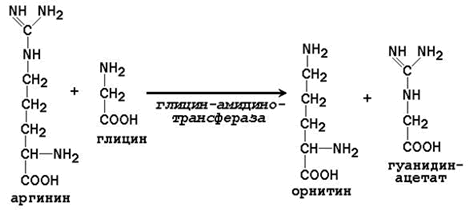
Синтез креатина в тканях человека протекает в две стадии. На первой стадии в почках образуется гуанидинацетат:
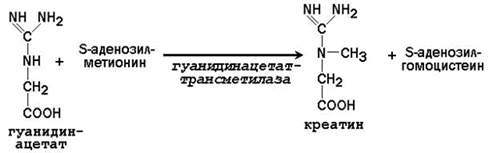
На второй стадии в печени происходит реакция трансметилирования:
25.3.2. Синтезированный в печени креатин поступает в кровь и доставляется в мышцы. Там он взаимодействует с АТФ, в результате чего образуется макроэргическое соединениекреатинфосфат. Эта реакция легко обратима.
В состоянии покоя мышцы накапливают креатинфосфат (его содержание в неработающей мышце в 3-8 раз выше, чем содержание АТФ). При переходе к мышечной работе изменяется направление реакции и образуется АТФ, необходимый для мышечного сокращения.
Образование АТФ при участии креатинфосфата – наиболее быстрый путь генерации АТФ. Запас креатинфосфата обеспечивает интенсивную работу мышц в течение 2 – 5 секунд. За это время человек успевает пробежать 15 – 50 метров. Тем временем включаются другие механизмы образования АТФ: мобилизация мышечного гликогена, окисление субстратов, поступающих из печени и жировой ткани.
Концентрация креатина в крови здоровых взрослых людей составляет приблизительно 50 мкмоль/л; в моче он практически отсутствует. Появление креатина в моче не всегда является симптомом заболевания. Так, у маленьких детей и подростков моча всегда содержит креатин (физиологическая креатинурия). При заболеваниях мышц, когда нарушается образование креатинфосфата, увеличивается содержание креатина в крови и возрастает его экскреция с мочой.
25.3.3. В результате неферментативного дефосфорилирования креатинфосфата образуется креатинин – ангидрид креатина.
Креатинин – один из конечных продуктов азотистого обмена в организме, он выводится с мочой. Суточное выделение креатинина у здорового человека пропорционально его мышечной массе. Креатинин не реабсорбируется в почечных канальцах, поэтому его суточная экскреция является показателем фильтрационной функции почек. Содержание креатинина в крови снижается при заболеваниях мышц и увеличивается при нарушении функции почек. Выделение креатинина с мочой снижается в обоих случаях.
Обмен фенилаланина и тирозина.
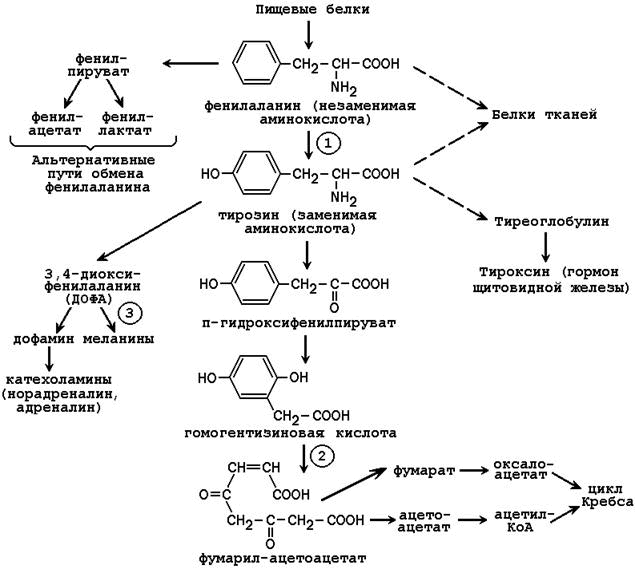
Обмен фенилаланина и тирозина в тканях человека можно представить в следующем виде (см. рисунок 25.1).
Рисунок 25.1. Пути обмена фенилаланина и тирозина в тканях (цифрами обозначены наиболее часто встречающиеся дефекты ферментов; далее приводится характеристика этих нарушений).
25.4.2. Известен ряд врождённых нарушений обмена фенилаланина и тирозина.
Фенилкетонурия – врождённое нарушение процесса гидроксилирования фенилаланина до тирозина. Заболевание чаще всего вызвано отсутствием или недостатком фермента фенилаланингидроксилазы (обозначен цифрой 1 на рисунке 25.1), реже - нарушением образования тетрагидробиоптерина.
Ранними симптомами фенилкетонурии являются повышенная возбудимость и двигательная активность, рвота и трудности вскармливания, с 3 – 5-го месяца нарушается интеллектуальное развитие, исчезает реакция на окружающее. Со временем у детей появляются судороги. Волосы и глаза обычно менее пигментированы, чем у других членов семьи. При отсутствии лечения продолжительность жизни больных составляет 20 - 30 лет.
Биохимическая основа фенилкетонурии – накопление фенилаланина в организме. Высокая концентрация аминокислоты стимулирует выработку фермента, превращающего фенилаланин вфенилпируват (в норме этот фермент малоактивен). Путём восстановления фенилпируват переходит в фениллактат, а путём декарбоксилирования – в фенилацетат. Эти продукты наряду с фенилаланином в существенных количествах обнаруживаются в моче больных.
В настоящее время имеются достоверные свидетельства того, что за токсическое повреждение мозга ответственны главным образом высокие концентрации фенилаланина. Повышенное содержание фенилаланина тормозит транспорт тирозина и других аминокислот через биологические мембраны. Это приводит к ограничению синтеза белка в клетках мозга и нарушению синтеза нейромедиаторов.
Раннюю диагностику заболевания нельзя провести исходя только из клинической симптоматики. Диагноз ставится биохимически путём скрининга всех новорождённых. Лечение больных фенилкетонурией основано на ограничении поступления фенилаланина в организм и снижения концентрации этой аминокислоты в плазме. С этой целью используются искусственные питательные смеси, в которых фенилаланин отсутствует (например, берлофен).
Алкаптонурия – врожденное нарушение обмена фенилаланина, вызванное отсутствием фермента оксидазы гомогентизиновой кислоты (цифра 2 на рисунке 25.1). Это приводит к нарушению образования малеилацетоацетата, расщепляющегося далее до фумарата и ацетоацетата. В раннем детском возрасте единственным проявлением дефицита фермента является изменение окраски мочи. Гомогентизиновая кислота секретируется в просвет канальцев и в значительном количестве выводится с мочой. На воздухе она окисляется, а затем полимеризуется в окрашенное соединение, которое окрашивает пелёнки в чёрный цвет. Экскреция гомогентизиновой кислоты зависит от содержания фенилаланина и тирозина в пище.
Следствием накопления гомогентизиновой кислоты в организме является охроноз - шиферно-голубой оттенок ушного и носового хрящей, вызванный накоплением в них пигмента. Развитие охроноза можно предотвратить, если с раннего возраста ограничивать поступление с пищей фенилаланина и тирозина.
Альбинизм развивается при отсутствии в пигментных клетках фермента тирозиназы (обозначена цифрой 3 на рисунке 25.1), которая участвует в образовании меланина. В результате волосы, кожа и глаза больного лишены этого пигмента. При альбинизме наблюдается повышение чувствительности к солнечным лучам и некоторое нарушения зрения.