ПОДПИСАТЬСЯ НА РАССЫЛКУ
Биохимические основы лекарственного применения ферментов и их ингибиторов, витаминов и гормонов
Тема: "БИОХИМИЧЕСКИЕ ОСНОВЫ ЛЕКАРСТВЕННОГО ПРИМЕНЕНИЯ ФЕРМЕНТОВ И ИХ ИНГИБИТОРОВ, ВИТАМИНОВ И ГОРМОНОВ".
1. Основные направления использования ферментов с лечебными целями. Понятие о заместительной энзимотерапии. Неспецифическое использование специфических свойств отдельных ферментов для устранения патологического процесса. Ограничения использования ферментных препаратов в медицинской практике.
2. Строение и свойства липосом, обусловившие их применение в медицине и фармации. Пути введения липосом.
3. Определение понятия «иммобилизованные ферменты». Пути иммобилизации ферментов. Носители, используемые для иммобилизации ферментов. Требования, предъявляемые к этим носителям.
4. Преимущества иммобилизованных ферментов перед нативными предшественниками. Примеры использования иммобилизованных ферментов в препаративных и аналитических целях.
5. Примеры использования ферментных препаратов для лечения тромбозов, воспалительных процессов, вирусных инфекций. Механизмы их действия.
6. Использование ингибиторов ферментов в качестве лекарственных препаратов (ингибиторы протеиназ, фибринолитических ферментов, ацетилхолинэстеразы, моноаминооксидазы, карбоангидразы, ксантиноксидазы, ацетальдегиддегидрогеназы).
7. Понятие об антивитаминах. Примеры использования витаминов и антивитаминов как лекарственных препаратов.
8. Примеры использования гормонов и их структурных аналогов гормонов как лекарственных препаратов.
|
Раздел 32.1 |
Энзимотерапия: основные направления, примеры. |
|
|
|
|
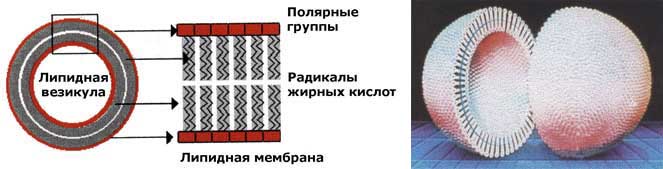
Идея использования ферментов в качестве лечебных средств возникла много лет тому назад. Однако возможность широкого их применения для лечения самых различных заболеваний появилась лишь в последние десятилетия, когда были получены кристаллические препараты ферментов. С каждым годом ферменты находят все большее применение в практической медицине. Расширяется также перечень ферментов, которые используются в комплексной терапии. В настоящее время в терапии различных болезней используются несколько десятков разных ферментных препаратов. Наиболее широкое применение нашли препараты лизирующего типа, прежде всего протеиназы поджелудочной железы (трипсин, химотрипсин, химопсин, панкреатин), протеолитический фермент крови плазмин (фибринолизин), фермент желудочного сока — пепсин и другие. Из препаратов растительного и микробного происхождения чаще всего используются протелин, кератиназа и папаин. Опубликованы положительные результаты действия гиалуронидазы, эластазы и коллагеназы. В последние годы решение проблемы применения ферментов для лечебных целей ведется в различных направлениях: 1. Восполнение образовавшегося в организме дефицита того или иного фермента путем введения в организм недостающего фермента. 2. Неспецифическое использование специфических свойств отдельных ферментов для устранения патологического процесса. Непосредственное отношение к данной проблеме имеет вопрос изучения возможностей применения в лечебной практике различных ингибиторов ферментов и коферментов. Заместительная энзимотерапияЗаместительная энзимотерапия — применение ферментов с целью компенсации врожденной или приобретенной функциональной недостаточности определенных органов, тканей или систем, например, поджелудочной железы, печени, желудка. В лечебной практике часто встречаются случаи, когда ферменты, расщепляющие (переваривающие) белки, жиры или углеводы, образуются в недостаточных количествах или слишком быстро инактивируются. Восполнение ферментного дефицита в желудочно-кишечном тракте легко достигается путем приема соответствующих природных смесей, содержащих необходимые ферменты (пепсин, трипсин, химотрипсин, карбоксипептидаза, амилаза, сахараза). Заместительная энзимотерапия дает положительный результат при различных заболеваниях печени, желчного пузыря, поджелудочной железы и собственно пищеварительного тракта. Применение ферментов полезно после операций на поджелудочной железе, при хронических панкреатитах, при нарушениях пищеварения в старости. Проблема доставки ферментов к месту назначения решается довольно легко, если дефицит ферментов касается крови, лимфы или экстрацеллюлярной жидкости. И, наоборот, устранение ферментного дефицита, возникшего в отдельных органах и тканях, является трудной и до сих пор практически не решенной задачей. Серьезным препятствием для проникновения внутрь клетки таких высокомолекулярных соединений, как ферменты, является наружная клеточная мембрана, состоящая из белкового и липидного слоев. Изучение возможности проникновения ферментов через клеточные мембраны является важнейшей задачей медицинской энзимологии. Имеются сообщения, в которых авторы предлагают вводить недостающие ферменты в клетку, поместив их предварительно в липосомы — искусственно полученные сферические замкнутые частицы диаметром от 0,5 до 10 мкм, образованные бимолекулярными липидными слоями. Такие структуры получают из водной суспензии фосфолипидов, обрабатывая ее ультразвуком высокой или низкой частоты.
Рисунок 32.1. Схема строения липидного бислоя липосомы (слева); пространственная структура липосомы (справа). Как лекарственные формы, липосомы имеют ряд преимуществ. Прежде всего, липосомы получают из веществ, которые не являются чужеродными для организма и поэтому не оказывают на него какого-либо неблагоприятного воздействия. Липосомы хорошо проникают через клеточные мембраны и тем самым обеспечивают более эффективный транспорт содержащихся в них лекарственных веществ внутрь клетки, чем при применении обычных препаратов.
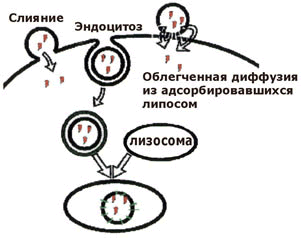
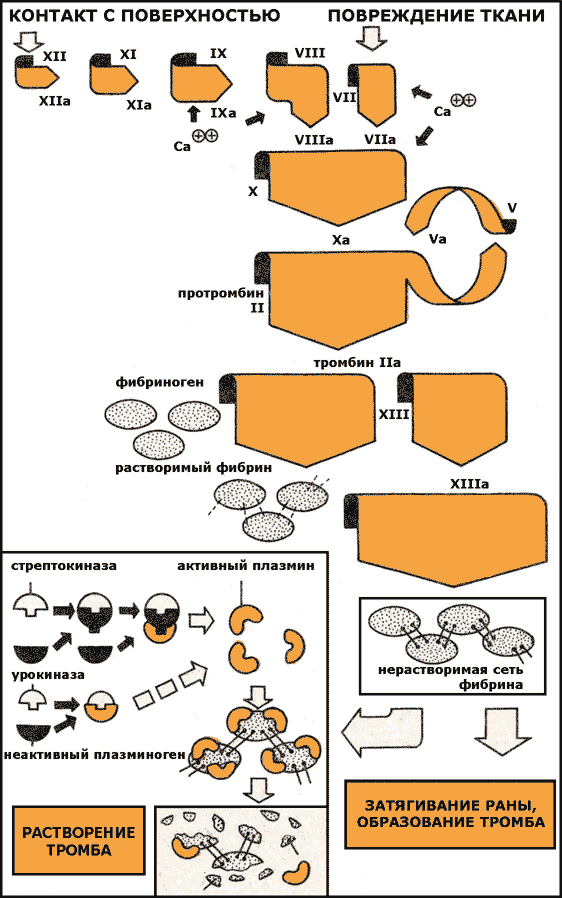
Рисунок 32.2. Способы проникновения содержимого липосом в клетку. Варьируя свойства липосомы, можно изменять условия транспорта веществ в отдельные части клетки. Установлено, например, что многослойные липосомы проникают внутрь клетки в неизмененном виде и поглощаются лизосомами, где под влиянием липаз происходит распад липосомы и высвобождение инкапсулированных в них лекарственных веществ. В отличие от этого, однослойные липосомы сливаются с плазматическими мембранами клеток и освобождают лекарственные вещества в цитоплазму. Таким образом, с помощью липосомы возможен направленный транспорт веществ, в том числе высокомолекулярных соединений белковой пророды, в цитоплазму или в некоторые органеллы клеток. Тромболитическая терапияШирокое применение в лечебной практике находят ферментные препараты, растворяющие сгустки и тромбы крови. Свертывание крови и фибринолиз имеют фундаментальное значение для физиологического равновесия в организме человека, для нормальной жизнедеятельности. Система свертывания крови обеспечивает циркуляцию крови в сосудах и тем самым — снабжение всех клеток и органов тела питательными веществами и кислородом, а также удаление отходов и конечных продуктов метаболизма. Одновременно эта система предохраняет организм от чрезмерной потери крови после повреждений. Свертывание крови — это комплексный, очень сложный процесс, который состоит из отдельных фаз и подвержен влиянию примерно 30 известных в настоящее время факторов, способствующих или противодействующих ему. Процесс, противоположный свёртыванию крови, называется фибринолизом. Механизмы обоих процессов, несмотря на их противоположные функции, весьма сходны. И в том и в другом случае активную роль играют протеолитические ферменты: при свертывании — тромбин, при фибринолизе — плазмин, которые вначале образуются в форме неактивных предшественников протромбиногена и плазминогена. Общая схема процессов свертывания и фибринолиза показаны на рисунке 6.3.
Рисунок 32.3. Свёртывание крови и фибринолиз. В результате каскада реакций внешнего и внутреннего механизмов свёртывания крови происходит образование активного тромбина из профермента протромбина. Тромбин вызывает полимеризацию мономеров, которыми являются молекулы фибриногена, превращая их в фибрин через стадию фибрин-мономеров. Нити фибриногена складываются в пучки — фибриногеновые волокна; далее эти волокна, соединяясь между собой, образуют пучки волокон фибрина. Поскольку свертывание крови и фибринолиз находятся в точно сбалансированном соотношении между собой, одновременно с процессом отложения пленки фибрина на интиме артерий происходит и растворение этой пленки в результате фибринолиза. Под действием плазмина от фибрина отщепляются пептидные цепи — полипептиды, которые растворимы и не способны к полимеризации. Патологические изменения (травма, повреждение сосуда, замедление кровотока, изменение химического состава крови и т. п.) смещают равновесие в сторону свертывания. Резкое усилие процесса свертывания может быть причиной тромбоэмболии (эмболия — закупорка сосудов, тромбоэмболия — эмболия оторвавшимися тромбами и их частицами). Однако путем активации фибринолитического процесса можно вновь восстановить равновесие. Тромбы, состоящие главным образом из скоплений тромбоцитов, заключенных в сеть фибрина, легко растворяются под действием протеаз. Возможны два пути тромболитической терапии, различающиеся по механизму действия 1) ферменты-лизокиназы (урокиназа, стрептокиназа) активируют плазминоген, превращая его в плазмин; 2) другие ферменты (плазмин, трипсин, химотрипсин) оказывают прямое физиологическое, тромболитическое действие. Имеются сообщения об успешном использовании ферментов для лечения тромбозов тазовых вен, головного мозга, эмболии легкого, тромбозов и эмболии периферических артерий, а также инфаркта миокарда. В отличие от терапии антикоагулянтами, лечение ферментами не сопряжено с опасностью кровотечения. Все это позволяет довольно широко использовать ферментативные препараты с целью лечения острых и хронических тромбофлебитов. Ферменты применяются в виде инъекций или вводятся в состав мазей. Вскоре после начала лечения отмечается заметное улучшение состояния больного: подавление воспалительного процесса, фибринолитический эффект, уменьшение боли и отека. Больному не грозит опасность кровотечения. Лечение воспалительных процессовИзвестно, что всякое заболевание сопровождается проявлением в какой-то степени воспалительной реакции. Любое нарушение в метаболизме клеток, вызванное химическими (токсическими), физическими (механическими) или биологическими (инфекционными) факторами, приводит к воспалению. Воспалительный процесс имеет сложную природу, в нем, в равной мере, участвуют кровь и кровеносные сосуды, лимфатическая системе и соединительная ткань. Важную роль в этом процессе играют ферментативные реакции. Поэтому логично применение ферментов при лечении воспалительных процессов. Энзимотерапия особенно эффективна при травмах. С помощью протеаз можно с успехом лечить последствия вывихов, сдавлений или разрывов, ликвидировать гематомы, устранять боль. Отмечаются стойкие положительные результаты при лечении ферментами невритов, гангрен, пролежней. Протеазы способствуют заживлению фурункулов, карбункулов, глубоких абсцессов и свищей. Имеется много сообщений о положительных результатах энзимотерапии при заболеваниях дыхательных путей и легких. Показано, что протеиназы, благодаря своему фибринолитическому и муколитическому действию, быстро разжижают различные секреты и эксудаты, чем способствуют их удалению из дыхательных путей. Ферменты оказались весьма эффективными при лечении различных воспалительных процессов в области уха, горла, носа: отите, ларингите, фарингите, при отеке после операций на носовой перегородке, миндалинах, барабанной перепонке. Ферменты используются также в офтальмологии для лечения глазных травм, аденовирусных заболеваний глаз, при операционных вмешательствах. Терапия ферментами применяется также и в стоматологической практике при воспалительных процессах в полости рта, пародонтозах, после удаления зубов и операций на их корнях. К настоящему времени накопился большой клинический опыт успешного местного применения протеиназ в хирургической практике при обработке ран, трофических и долго незаживающих язв, лечении остеомиелитов, ожогов, отморожений и других гнойно-воспалительных и некротических процессов, трудно поддающихся обычному лечению. Есть сообщения о целесообразности применения в хирургии протеолитических ферментов для предупреждения послеоперационных спаек брюшной полости. Для рассасывания посттравматических рубцов и других затвердений, вызываемых развитием соединительной ткани, целесообразно применение фермента гиалуронидазы. Под влиянием этого фермента происходит расщепление гликозаминогликанов (мукополисахаридов), что ведет к повышению проницаемости тканевых мембран и облегчает проникновение жидкостей из полостей и тканей в кровь. Поэтому гиалуронидаза применяется для облегчения проникновения лекарств через межклеточные субстанции при лечении процессов, связанных с разрастанием соединительной ткани, а также при кожно-пластических операциях. Лечение вирусных инфекцийИспользование ферментов для лечения вирусных заболеваний основано на том, что вирусы, находясь вне клетки, не способны вырабатывать какие бы то ни было ингибиторы для защиты собственных белков от действия протеаз. Следовательно, протеолитические ферменты могут разрушить или инактивировать белковую оболочку вируса в период его внеклеточного существования и таким образом предотвратить его проникновение в клетку. Таким образом, повышение протеолитической активности крови и плазмы может быть эффективным средством борьбы с вирусными инфекциями. Положительные результаты терапии ферментами могут быть достигнуты при лечении таких вирусных заболеваний у человека, как опоясывающий лишай, вирусная пневмония, паротит (свинка), корь, краснуха. Значительно сокращается длительность болезни, не возникают осложнения. Имеются также сообщения об использовании ферментов, расщепляющих нуклеиновые кислоты (дезоксирибонуклеазы и рибонуклеазы) при лечении аденовирусных инфекций (опоясывающем лишае, вирусных пневмониях). |
|
| Раздел 32.2 |
Иммобилизованные ферменты и их использование в медицине. |
|
|
|
|
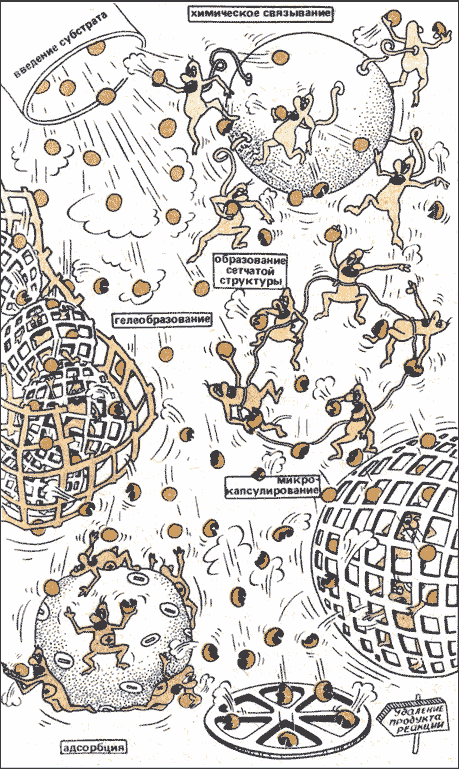
Ферменты — вещества белковой природы и поэтому неустойчивы при хранении, а так же чувствительны к тепловым воздействиям. Кроме того, ферменты не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов. Начало этому было положено в 1916 году, когда Дж. Нельсон и Е. Гриффин адсорбировали на угле инвертазу и показали , что она сохраняет в таком виде каталитическую активность. Сам термин был «иммобилизованные ферменты» узаконен в 1971 году, и означает любое ограничение свободы передвижения белковых молекул в пространстве. Иммобилизованные ферменты — это искусственно полученные комплексы фермента с нерастворимым в воде носителем. Иммобилизация (от лат. immobilis - «неподвижный») осуществляется: путем физической адсорбции фермента на нерастворимом материале; включения фермента в ячейки геля; а так же ковалентным связыванием фермента с нерастворимым материалом или молекул фермента между собой с образованием нерастворимых полиферментных комплексов. Преимущества иммобилизованных ферментов перед нативными предшественниками1. Гетерогенный катализатор легко отделим от реакционной среды, что даёт возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт. 2. Ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость реакции и выход продукта. 3. Модификация фермента целенаправленно изменяет его свойства, такие как специфичность, зависимость от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям. 4. Можно регулировать каталитическую активность иммобилизованных ферментов путём изменения свойств носителя действием физических факторов, таких как свет и звук. Иммобилизовать ферменты можно как путём связывания на нерастворимых носителях, так и путём внутримолекулярной и межмолекулярной сшивки белковых молекул низкомолекулярными бифункциональными соединениями, а также путём присоединения к растворимому полимеру. Методы иммобилизацииРазработаны многочисленные методы иммобилизации. На рис. 32.4 показаны важнейшие из них. Ферменты могут связываться с носителем химически (ковалентно), а также физически — путем адсорбции или путем закрепления на носителе за счет электростатических взаимодействий. Под действием специальных реагентов молекулы ферментов могут соединяться между собой (образуя «сеть»). Их удается также механически заключать в гели или микрокапсулы. Путем иммобилизации можно повлиять на характерные свойства того или иного фермента, например его активность, стабильность, оптимальную рабочую температуру, оптимальное значение рН, а также способность связываться с субстратом.
Рисунок 32.4. Основные способы получения иммобилизованных ферментов. Ковалентное связывание с активированными полимерами. Иммобилизация ферментов путем их ковалентного связывания с активированными полимерами представляет собой, вероятно. Наиболее широко распространенный метод, т.к. несмотря на его трудоемкость, он позволяет получить иммобилизованный фермент, прочно связанный с полимерным носителем. Сополимеризация с помощью многофункциональных групп. Многофункциональные реагенты можно использовать не только для присоединения молекул фермента к целлюлозе или другим полимерам, но и для связывания молекул фермента друг с другом. К наиболее широко используемым многофункциональным реагентам относится глутаровый альдегид. Гелеобразующее действие альдегидов было отмечено Бэйкером ещё в 1910 году. По существу, это старое наблюдение не утратило своего значения и сегодня. Для того, что бы получить нерастворимую матрицу, состоящую из фермента и глутарового альдегида, необходимо либо заполимеризовать глутаровый альдегид, либо осадить фермент. В результате увеличивается длина связывающей молекулы или уменьшается расстояние между молекулами фермента. Основной недостаток методов такого типа заключается в том, что бифункциональные реагенты часто очень хорошо взаимодействуют с активным центром фермента, тем самым инактивируя его. Однако в тех случаях, когда это удаётся избежать, например, путём обратимого блокирования активного центра, метод даёт хорошие результаты. Физическая адсорбция. Самым старым из применяемых методов иммобилизации ферментов является физическая адсорбция на полимерной матрице без ковалентного связывания. Осуществить такую адсорбцию чрезвычайно просто: адсорбент и фермент в течение некоторого времени перемешивают вместе. Однако выход связанного фермента мал, и при этом фермент частично или полностью инактивируется. Применялось множество различных адсорбентов. Сорбция может происходить с помощью ионных, гидрофобных и водородных связей, а также за счёт вандерваальсовых сил. Недостатком такого метода является то, что обратимая природа связывания фермента с носителем в самый ответственный момент может привести к его десорбции. Одной из причин, часто вызывающих десорбцию фермента, служит добавление субстрата. Это особенно трудно предотвратить, т.к. остальные факторы, способные вызывать десорбцию такие, как изменение рН, температуры, или ионной силы можно контролировать, но ни один фермент не функционирует без своего субстрата. Пространственное разделение. Для пространственного разделения молекулы фермента и свободного раствора можно использовать один из 3 методов:
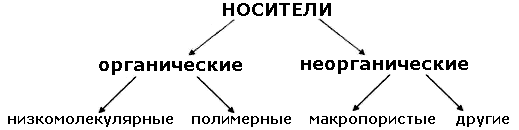
Важной особенностью первых двух способов заключается в том, что фермент фактически ни к чему не прикрепляется. Благодаря этому отсутствуют стерические помехи, возникающие при ковалентном и электростатическом связывания фермента с полимером. Носители для иммобилизованных ферментовДля получения иммобилизованных ферментов используется ограниченное число как органических, так и неорганических носителей. К носителям предъявляются следующие требования:
Схематическая классификация носителей
Для иммобилизации ферментов наиболее широко применяют природные полисахариды и синтетические носители полиметильного типа, остальные применяются значительно реже. Большое значение природных полимеров в качестве носителей для иммобилизации объясняется их доступность, и наличием реакционно-способных функциональных групп, легко вступающих в химические реакции. Характерной особенность этой группы носителей также является их высокая гидрофильность, Недостаток природных полимеров- неустойчивость к воздействию микроорганизмов и довольно высокая стоимость. Наиболее часто для иммобилизации используются такие полисахариды, как целлюлоза, декстран, агароза и их производные. Целлюлоза гидрофильная, имеет много гидроксильных групп, что позволяет модифицировать её, замещая эти группы. Для увеличения механической прочности целлюлозу гранулируют путём частичного гидролиза, в результате чего разрушаются аморфные участки. Гранулированную целлюлозу довольно легко превратить в различные ионообменные производные, такие как ДЭАЭ-целлюлоза, КМЦ и т.д. Особенности использования иммобилизованных ферментов в медицине1. Наиболее широко и эффективно процессы иммобилизации применяются для создания более стабильных форм, легко разрушающихся и теряющих свою активность медицинских препаратов. Так иммобилизация медицинских ферментов позволяет значительно увеличить сроки их хранения, делает их более устойчивыми к воздействию внутренних сред организма, позволяет сохранить первоначальную активность ферменте в течение продолжительного времени. 2. Успех использования иммобилизованных препаратов в значительной мере определяется правильным выбором носителя для иммобилизации и метода иммобилизации. Иммобилизация лекарственных веществ на различных природных и синтетических полимерах не только повышает гидролитическую способность этих соединений, но и приводит к увеличению эффективности самих лекарств. 3. Разработанные методы иммобилизации биологических активных соединений на неорганических матрицах позволяют проводить процессы модификации ряда хирургических инструментов и аппаратов, а также поверхностей различных эндопротезов, заменяющих работу важнейших органов человека. На основе иммобилизованной уреазы созданы и прошли успешные испытания портативные аппараты искусственной почки. По мнению многих специалистов, на смену эре антибиотиков и гормональных препаратов приходит эра ферментов. Иммобилизованные ферменты успешно используются для удаления различных вредных метаболитов, лечения некоторых злокачественных новообразований. В практической медицине используются различные типы повязок, тампонов с иммобилизованными на их поверхности ферментами, антибиотиками, антисептиками и т.д.. 4. Процессы иммобилизации широко применяются в медицине для аналитических и препаративных целей. С применением иммобилизованных препаратов разработаны более точные и экономические методы массовых клинических анализов для определения глюкозы, молочной кислоты и инсулина в крови, мочевины в сыворотке крови, галактозы в моче, пенициллина в фармацевтических препаратах. |
|
| Раздел 32.3 |
Использование ингибиторов ферментов для лечения заболеваний. |
|
|
|
|
Важное практическое значение для терапевтических целей приобретают ингибиторы ферментов как естественного происхождения, так и синтетические. Особенно широкое признание получили ингибиторы протеаз для лечения патологических состояний, вызванных активацией протеолитических систем крови и тканей. Ингибиторы протеиназИнгибиторы протеолитических ферментов применяются при лечении острого панкреатита. По мнению многих авторов, основной причиной развития этого заболевания является активация ферментов поджелудочной железы непосредственно в протоках с помощью особых факторов — цитокиназ, превращающих трипсиноген в трипсин. (В физиологических условиях, как известно, ферменты находятся в поджелудочной железе в неактивной форме. Их активация происходит лишь при поступлении в кишечник). Активируются и другие ферменты (калликреиноген, химотрипсиноген, проэластаза и другие), что приводит к аутокаталитическим процессам (самоперевариванию тканей железы), внутритканевым кровоизлияниям, отеку и другим изменениям. Применение ингибиторов положило начало новому этапу в лечении панкреатитов. С этой целью с успехом используются ингибиторы трипсина, в особенности тразилол (получают из околоушной железы крупного рогатого скота), пантрипин (из поджелудочной железы) и контрикал (из легких). Введение препаратов проводится внутривенно. Степень развития заболевания и его исход будут зависеть от состояния системы трипсин-ингибитор. Если ингибитора достаточно и система обладает компенсаторными способностями, то активированный фермент нейтрализуется; равновесие в системе восстанавливается. При дефиците ингибитора равновесие нарушается и процесс получает дальнейшее развитие. Ингибиторы фибринолизаАнтитрипсиновые препараты (трасилол, контрикал, пантрипин) используются также для лечения и профилактики кровотечений, вызванными активацией в организме процессов фибринолиза при проведении хирургических операций и в послеоперационном периоде. Они образуют неактивный комплекс с фибринолизином крови, предотвращая тем самым его влияние на фибрин. Другая группа ингибиторов фибринолиза включает синтетические препараты, из которых наибольшее распространение получила аминокапроновая кислота. В химическом отношении она близка к аминокислоте лизину: блокирует по конкурентному типу каталитический центр активатора, который связывается с лизиновым концом молекулы плазминогена. Помимо подавления активатора плазминогена, аминокапроновая кислота снижает активность самого плазмина. Это действие менее выражено, но оно имеет большое значение в тех случаях, когда в качестве активаторов выступают киназы тканей. Синтетические ингибиторы фибринолиза назначают внутрь или внутривенно при фибринолитических кровотечениях, возникающих во время операций на сердце, легких, мозге, надпочечниках и других органах, богатых тканевыми лизокиназами, активирующими плазминоген. Их назначают также для уменьшения кровопотерь вовремя родов и акушерских операций, при тромбоцитопении, гемофилии, заболеваниях печени и при массивных переливаниях консервированной крови. Ингибиторы ацетилхолинэстеразыСогласно современным представлениям, передача возбуждения в центральной и периферической нервной системе осуществляется при участии специальных биомолекул - нейромедиаторов или нейротрансмиттеров. Они высвобождаются в процессе передачи нервного импульса из нервного окончания в синаптическую щель, воздействуют на постсинаптический рецептор, что сопровождается соответствующим физиологическим ответом. Одним из таких нейромедиаторов является ацетилхолин. |
|
Ингибиторы ацетилхолинэстеразы средства подавляют действие этого фермента и тем самым способствуют накоплению и усилению действия ацетилхолина, выделяющегося в окончаниях холинергических нервов. Их эффект, следовательно, напоминает действие ацетилхолина (более выраженное и более продолжительное) и холиномиметических веществ, т. е. обладают М- и Н-холиномиметическим действием: повышение тонуса и сократительной активности гладких мышц, замедление пульса, снижение сократительной способности миокарда и скорости распространения возбуждения по проводящим путям, усиление секреции разных желез (М-холиномиметический эффект), обеспечение в малых дозах передачи импульсов в вегетативных ганглиях и усиления нервно-мышечной передачи (никотиноподобный эффект). Мышечные подергивания, в частности, могут явиться показателем наступающей фазы токсического действия.
Исходя из стойкости взаимодействия антихолинэстеразных средств с ацетилхолинэстеразой они подразделяются на группу обратимых (физостигмин, прозерин, галантамин) и группу необратимых (фосфакол, армин, пирофос) ингибиторов холинэстеразы; к этой группе относятся и фосфорорганические соединения — инсектициды, пестициды и др.
Препараты первой группы взаимодействуют с анионным и эстеразным центрами ацетилхолинэстеразы, вызывая временное, относительно непродолжительное угнетение активности фермента. С анионным центром за счет электростатических сил связывается положительно заряженный четвертичный или третичный атом азота молекулы лекарственного средства; а с эстеразным центром — углерод их карбонильной группы. Прочность образующихся при этом компонентов определяется устойчивостью ингибитора по отношению и эстеразному центру фермента и способностью ацетилхолина конкурировать с ингибитором за субстрат. Препараты группы антихолинэстеразных средств обратимого действия применяются в офтальмологии (для сужения зрачка и понижения внутриглазного давления при глаукоме), при лечении миастении, атонии кишечника и мочевого пузыря. Они противопоказаны при бронхиальной астме.
Препараты второй группы взаимодействуют с эстеразным центром фермента, фосфорилируя его, образуют стойкий, прочный комплекс, который не разрушается (практически разрушается весьма медленно) и не позволяет восстановиться активности ацетилхолинэстеразы. Эстеразный центр фермента практически не разрушает такой ингибитор. Активность его подавляется необратимо.
Ингибиторы моноаминоксидазы
Моноаминооксидаза (МАО) — фермент, вызывающий окислительное дезаминирование и инактивацию моноаминов, в том числе норадреналина, дофамина, серотонина, то есть основных нейромедиаторов, способствующих передаче нервного возбуждения в центральной нервной системе. МАО локализована преимущественно интранейронально, в митохондриях и частично в везикулах.
Ингибиторы МАО ипразид и ниаламид представляют собой производные гидразина; они способствуют накоплению моноаминов в синаптической щели. Тем самым повышают активность моноаминергических систем мозга, которая снижается при депрессивных состояниях.
Ингибиторы МАО обладают положительным влиянием на эффективную сферу больного, улучшением настроения и общего психического состояния. Они нашли применение и при ряде нейровегетативных и соматических заболеваний с явлениями депрессий, которые выражены в той или иной степени. Препараты усиливают и увеличивают продолжительность действия снотворных веществ обезболивающих и других нейротропных средств.
Следует отметить, что данные препараты инактивируют не только моноаминоксидазу мозга, но и одновременно некоторые ферменты печени, участвующие в обезвреживании ряда эндогенных токсических продуктов. Поэтому ингибиторы МАО обладают высокой токсичностью. При их применении следует исключить употребление пищевых продуктов (сыр, кофе, пиво), содержащих тирамин и фенилэтиламин, разрушающихся в тонком кишечнике и печени под влиянием моноаминоксидазы, что обусловливает их сосудосуживающее и гипертензивное действия.
Ингибиторы карбоангидразы
Карбоангидраза — фермент, участвующий в процессе гидратации и дегидратации угольной кислоты, преимущественно в клетках проксимальных почечных канальцев. Его ингибитором является диакарб, используемый в качестве мочегонного средства (диуретика).
Диуретический эффект диакарба основан на том, что уменьшение образования угольной кислоты приводит к снижению реабсорбции ионов бикарбоната и ионов натрия эпителием канальцев и повышению выделения их с мочой, в связи с чем значительно увеличивается выделение воды. Одновременно происходит увеличение выделения с мочой ионов калия. В связи с усиленным выведением бикарбонатов из организма уменьшается щелочной резерв крови и может развиваться ацидоз.
Препарат наиболее эффективен при отеках, обусловленных легочно-сердечной недостаточностью, при которой необходимо снизить высокое содержание в крови углекислоты и бикарбонатов.
Ингибиторы ксантиноксидазы
Аллонуринол является конкурентным ингибитором ксантиноксидазы. Этот фермент катализирует образование мочевой кислоты из пуриновых оснований. Под действием аллопуринола понижается образование солей мочевой кислоты (уратов) в крови и отложение их в тканях. Уменьшается также выделение уратов почками, что снижает вероятность образования в них камней.
Аллопуринол назначают под для лечения и профилактики подагры и некоторых форм мочекаменной болезни, сопровождающихся гиперурикемией (повышением содержания уратов в крови). Препарат применяют под контролем уровня мочевой кислоты в крови и моче.
Ингибиторы ацетальдегиддегидрогеназы
Препараты тетурам и циамид применяют для лечения хронического алкоголизма. Действие этих препаратов основано на способности влиять на обмен алкоголя в организме. Алкоголь, окисляясь, проходит через фазу ацетальдегида и уксусной кислоты. Ацетальдегид при участии фермента ацетальдегиддегидрогеназы быстро окисляется. Тетурам, блокируя ацетальдегидроксидазу, задерживает процесс окисления и обусловливает увеличение концентрации ацетальдегида в крови, что приводит к изменению дыхания и кровообращения, сопровождающихся неприятными ощущениями: покраснение и чувство жара в лице и верхней части туловища, затруднение дыхания, шум в голове, сердцебиение, чувство страха, иногда озноб; артериальное давление значительно понижается. Назначая алкоголь на фоне действия тетурама вырабатывают отрицательный условный рефлекс на вкус и запах спиртных напитков и добиваются определенной непереносимости алкоголя.
ОБНОВЛЕНИЯ
ПОДПИСАТЬСЯ НА РАССЫЛКУ
ПРЕДМЕТЫ
- Анатомия
- Акушерство и гинекология
- БЖД, медицина катастроф
- Биохимия
- Биология
- Гистология
- Гигиена
- Генетика
- Диетология
- Дерматовенерология
- Инфекционные болезни
- Культурология
- Лабораторная диагностика
- Летняя практика
- Лучевая диагностика
- Медицинская информатика
- Микробиология
- Неврология
- Общественное здоровье
- Общий уход
О НАС
«Dendrit» - информационный портал для медицинских работников, студентов медицинских ВУЗов, исследователей и пациентов.
Ваш источник новостей и знаний о здоровье.